

拔牙后,牙槽骨不均匀吸收导致软组织塌陷,阻碍了完全再生。骨质流失使得进行牙科植入和修复更加困难。受骨骼生物结构的启发,设计了一种可变形的SIS/HA(小肠粘膜下层/羟基磷灰石)复合水凝胶同轴支架来维持牙槽中的骨量。SIS/HA支架含有GL13K作为外层,模拟致密骨,而载有骨髓间充质干细胞来源外泌体(BMSCs-Exos)的SIS水凝胶作为支架的内核,类似于骨骼中的软组织。该同轴支架表现出0.82 MPa的弹性模量,使其能够自适应填充拔牙窝并维持成骨空间。同时,该复合支架富含BMSCs-Exos的内层促进了人脐静脉内皮细胞(HUVECs)和BMSCs向支架内部的增殖和迁移(约为对照组的3倍),上调了与成骨(BMP2、ALP、RUNX2和OPN)和血管生成(HIF-1α和VEGF)相关的基因表达。这诱导了支架内新血管和骨生长,解决了缺陷中心骨形成率低的问题。GL13K在前三天释放了约40.87±4.37%,发挥局部抗菌作用,进一步促进周边区域的血管化和新骨形成。该设计旨在通过同轴支架的内外双重机制在拔牙窝中实现全方位和高效的骨修复效果。
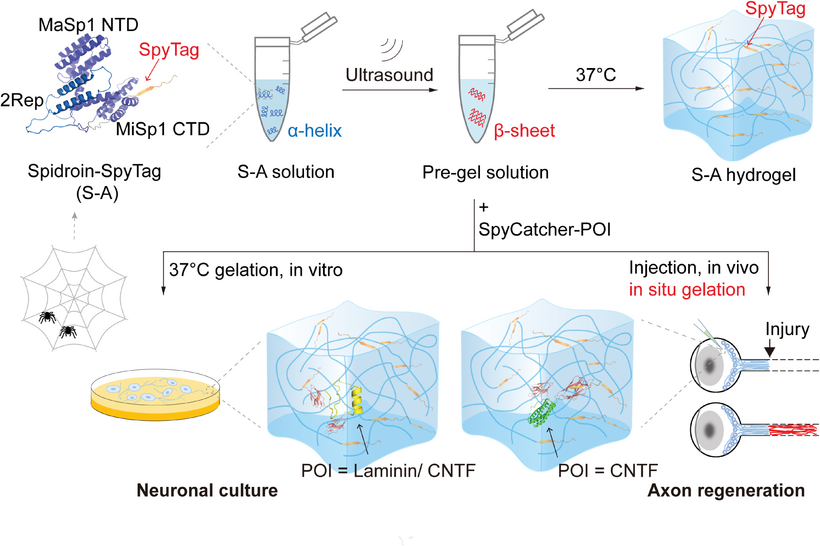
以非侵入性、安全和持续的方式递送蛋白质类治疗药物,且无需依赖病毒递送系统,这对于治疗各类慢性损伤和疾病至关重要。在众多挑战中,实现中枢神经系统损伤或疾病后的轴突再生和功能恢复,对大多数临床干预措施来说仍然难以实现,这持续推动着创新解决方案的需求。本研究开发了一种基于重组蜘蛛丝蛋白(丝素蛋白)的热响应性水凝胶系统。该蛋白质溶液经短暂超声处理后,在升高温度(37°C)时能快速发生溶胶-凝胶转变。这种热触发的凝胶化赋予了系统可注射性。利用SpyTag/SpyCatcher化学,由SpyTag融合丝素蛋白构成的水凝胶可以与各种SpyCatcher融合的生物活性基序功能化,如神经营养因子(如睫状神经营养因子)和细胞结合配体(如层粘连蛋白),使其非常适合神经元培养。更重要的是,将装饰有SpyCatcher融合CNTF的蛋白质材料玻璃体内注射到视神经损伤后的玻璃体中,可导致JAK/STAT3信号通路的持续激活、神经元存活率提高和轴突再生增强。本研究展示了一个用于神经保护和再生的可注射、持续递送蛋白质治疗药物的通用材料系统,并可能扩展应用于其他慢性疾病和损伤的治疗。
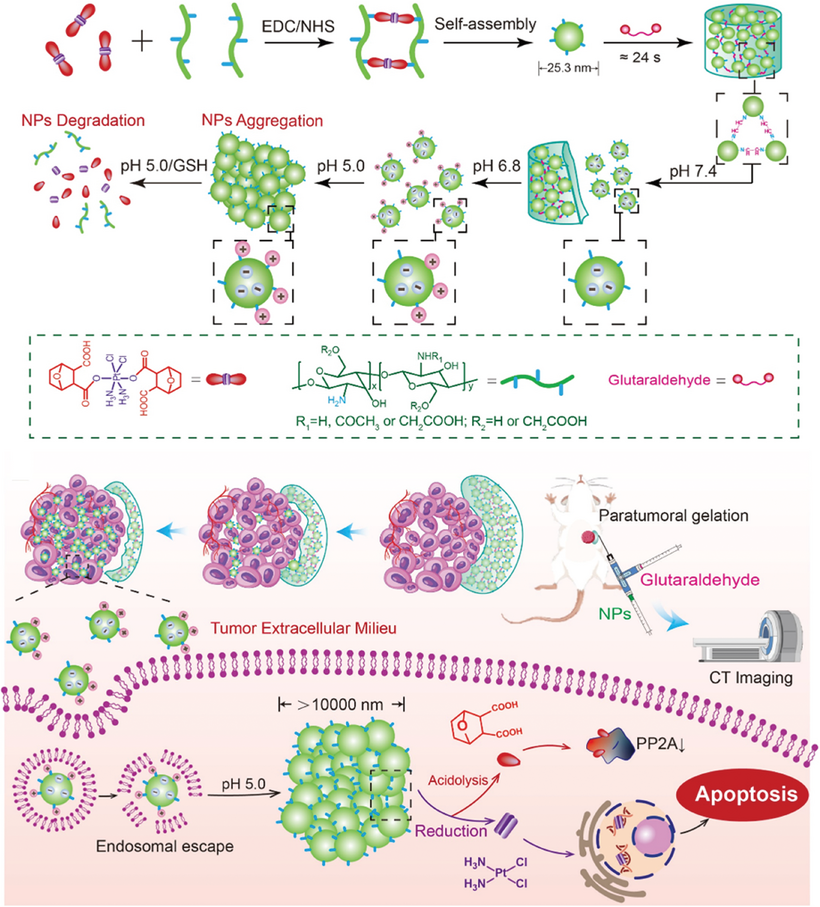
局部注射型肿瘤治疗与诊断纳米复合水凝胶由于其将两种系统的优势集成并同时最小化其缺点,展现出了巨大的临床转化潜力。然而,如何高效地让纳米药物从水凝胶中释放,并克服肿瘤渗透与积累之间的内在冲突,直接决定了其治疗与诊断效率。本文开发了一种通过席夫碱反应合成的集群导弹灵感动态纳米复合水凝胶,该水凝胶由交联的协同尺寸可变化的纳米前药(NPs)与戊二醛(GA)组成。类比集群导弹,该水凝胶能够高效释放初始尺寸为25.3 nm的纳米药物,响应肿瘤外部pH环境进行深度肿瘤分布和细胞内摄取,同时在肿瘤细胞内部pH和谷胱甘肽(GSH)的响应下,精确调控细胞内积累并高选择性地释放药物,从而实现强效的局部化化疗。此外,纳米药物中的铂重金属赋予水凝胶监测自身及肿瘤组织动态变化的能力,无需额外常规成像剂。因此,这种集群导弹灵感的动态纳米复合水凝胶为精确局部肿瘤治疗与诊断提供了新的临床应用路径。
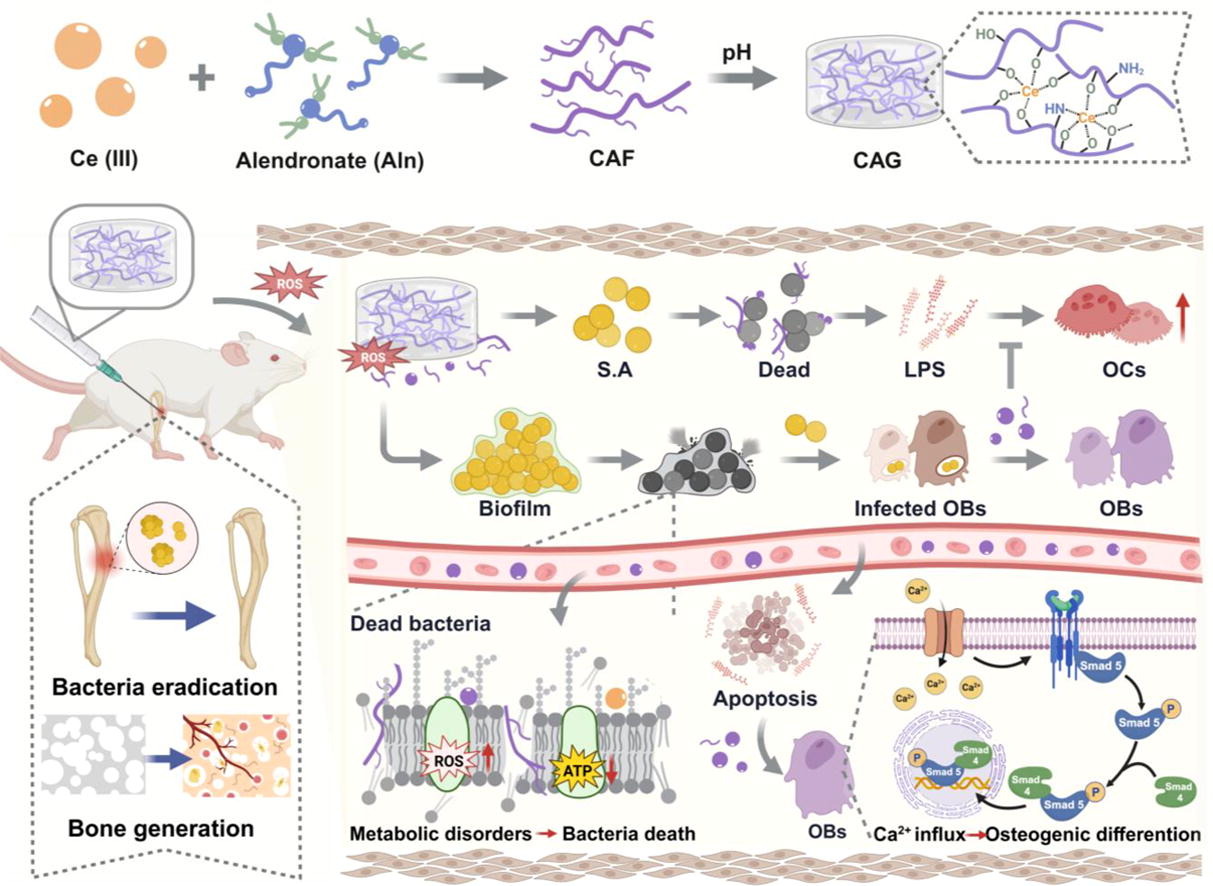
随着骨髓炎发生率的增加以及抗生素滥用导致耐药性细菌的出现,传统治疗面临巨大挑战。细菌增殖和细胞内感染通过形成生物膜,导致反复和长期的感染。同时,细菌感染引发的免疫反应破坏了骨骼的新陈代谢平衡,导致炎症性骨吸收。在此,开发了一种具有多重抗菌能力和骨代谢调节作用的铈-阿伦膦酸盐超分子水凝胶(CAG),旨在解决骨髓炎的多方面挑战。CAG水凝胶具有可注射和自愈的特点,在反应性氧种(ROS)微环境下表现出对金黄色葡萄球菌(S.A)和大肠杆菌(EcN)的显著抗菌活性,有效破坏生物膜并消除细胞内感染。CAG中的Ce离子通过破坏细菌膜和干扰细菌膜电位,抑制细菌的能量产生。此外,CAG成功逆转了内毒素引起的凋亡和成骨细胞的异常分化。RNA测序结果显示,CAG通过促进钙离子流入,调节钙信号通路和TGFβ通路,上调与Bmp2/Smad5通路相关蛋白的表达,从而促进成骨分化。在体内实验中,CAG成功治疗了由金黄色葡萄球菌引起的骨髓炎,并在7天和28天的骨髓炎小鼠模型中改善了骨组织生成。总体而言,本研究提出了一种综合疗法,旨在针对整个阶段的细菌感染并恢复骨代谢平衡,提供了一种创新的骨感染治疗方法。
维持创伤的热环境对于促进组织修复和再生至关重要。然而,作为一种热疗再生治疗的潜力仍未被充分阐明。本研究展示了一种通过简单“一步”激活过程构建的光热混合水凝胶,该水凝胶能够提供稳定的光热循环能力,激活免疫反应,加速组织氧化还原和免疫稳态的恢复,最终促进创伤愈合。研究结果表明,光热HGBM水凝胶在受损创伤愈合模型中的应用,显著提高了活性氧(ROS)水平,增强了免疫反应,促进了巨噬细胞极化(M2/M1),从而诱导了促再生反应。RNA测序数据表明,45°C的温和热疗法增强了免疫反应和呼吸爆发过程,从而调节了受损组织中的免疫微环境。此外,这一过程使创伤的炎症状态向抗炎和促愈合状态过渡,这一转变由白介素-10和白介素-4等因子的产生所促进。因此,本研究提供了一种有效的热疗再生治疗策略,适用于皮肤创伤修复和组织再生。
脊髓损伤(SCI)后,巨噬细胞迅速激活并向M1表型极化,抑制M1样巨噬细胞已成为一种有前景的SCI治疗方法。金属调节蛋白能够高亲和力和特异性地感知特定金属离子,在免疫调节中发挥关键作用。在此,我们筛选了与金属调节蛋白相关的各种生物活性金属离子,发现Zn2+和Mn2+能有效抑制M1极化。基于这些发现,我们开发了由Zn2+与Mn2+配位自组装形成的弱碱性ZnMn基层状双氢氧化物(ZnMn-LDHs)来抑制M1样巨噬细胞。ZnMn-LDHs有效中和酸性环境并促进金属调节蛋白的表达,包括金属硫蛋白(MT)、超氧化物歧化酶1(SOD1)和超氧化物歧化酶2(SOD2),从而产生强大的M1样巨噬细胞抑制作用。更重要的是,巨噬细胞在ZnMn-LDHs调节后释放的神经生长因子(NGF)促进了雪旺细胞的延伸和铺展。通过将ZnMn-LDHs与丝素蛋白(SF)整合,构建了用于SCI修复的ZnMn@SF注射型水凝胶。体内动物模型进一步揭示了ZnMn@SF水凝胶在治疗SCI时的优异抗炎效果,促进了功能恢复。我们的研究结果强调了金属离子调节的金属调节蛋白在抑制M1样巨噬细胞中的重要性,为SCI治疗提供了一种有前景的治疗策略。
生物活性分子在调节各种骨形成过程中显示出巨大潜力,使其成为骨再生的理想治疗选择。然而,生物活性分子的广泛应用受到体内低蓄积和短半衰期的限制。水凝胶作为理想载体已经崭露头角,可以解决这些挑战,具有延长病变部位滞留时间、延长体内半衰期、减轻副作用、避免突释和促进生理条件下吸收等潜力。本综述系统总结了生物活性分子负载水凝胶在骨再生领域的最新进展,包括颅骨缺损修复、股骨缺损修复、牙周骨再生和伴有基础疾病的骨再生等应用。此外,本综述讨论了通过刺激响应递送、载体辅助递送和序贯递送等策略改善生物活性分子释放特性的现有策略。最后,本综述阐明了水凝胶包封生物活性分子在骨再生领域面临的现有挑战和未来发展方向。
本文概要 1.胰腺癌对化疗或免疫治疗的反应率很低。尽管微创不可逆电穿孔(IRE)消融是治疗不可切除胰腺癌的一种很有前途的选择,但这种肿瘤类型的免疫抑制肿瘤微环境使肿瘤复发。因此,增强内源性适应性抗肿瘤免疫对于改善消融治疗和消融后免疫治疗的结果至关重要。 2.在这里,本文提出了一种水凝胶微球疫苗,它通过在肿瘤床相对较低的pH下释放FLT3L和CD40L来增强消融后的抗癌免疫反应。该疫苗促进肿瘤驻留的1型常规树突状细胞(cDC1)迁移到肿瘤引流淋巴结(TdLN),从而启动cDC1介导的抗原交叉呈递级联反应,从而增强内源性CD8+ T细胞应答。 3.本研究在雄性小鼠原位胰腺癌模型中发现,水凝胶微球疫苗以安全有效的方式将免疫冷肿瘤微环境转化为热环境,从而显著提高生存率并抑制远处转移瘤的生长。
导电水凝胶需要可调节的机械性能、高电导率和复杂的 3D 结构,才能在(生物)应用中实现高级功能。在这里,本文设计了一种简单的策略,通过可编程打印油内富含聚(3,4-乙撑二氧噻吩):聚(苯乙烯磺酸)(PEDOT:PSS)的水性墨水来构建3D导电水凝胶。在这种液包液印刷方法中,来自水相的PEDOT:PSS胶体颗粒和来自另一相的聚二甲基硅氧烷表面活性剂的组装体在液-液界面形成弹性膜,从而将水凝胶前体油墨捕获在设计的3D非平衡形状中,以便随后凝胶化和/或化学交联。在两个互穿水凝胶网络中,当 PEDOT:PSS 含量低至 9mgmL−1 时,电导率高达 301 S m−1。轻松的可印刷性使我们能够调整水凝胶的成分和机械性能,从而促进这些导电水凝胶作为电微流体设备的使用,并在未来定制近场通信(NFC)植入式生物芯片。
基于 RNA 的疗法在基因水平的疾病干预方面显示出了巨大的前景,其中一些疗法已被批准用于临床。RNA疗法的临床成功很大程度上取决于使用化学修饰、配体缀合或非病毒纳米粒子来提高RNA稳定性并促进细胞内递送。与分子级或纳米级方法不同,宏观水凝胶是柔软的、水溶胀的三维结构,具有生物可降解性、可调节的理化性质和可注射性等显着特征,最近它们在RNA治疗中的应用引起了极大的关注。具体来说,水凝胶可以被设计为对 RNA 治疗剂的释放进行精确的时空控制,从而有可能最大限度地减少全身毒性并增强体内疗效。本综述全面概述了 RNA 的水凝胶负载和控释水凝胶设计,重点介绍了它们的生物医学应用,并提供了我们对 RNA 递送这一令人兴奋的领域的机遇和挑战的看法。
