
肠道菌群参与了结肠癌的发生发展,一些致病菌如脓杆菌可以促进肿瘤的生长和转移。肿瘤为致病菌提供生存环境,形成病原体-肿瘤共生关系。破坏这种共生关系可能是肿瘤治疗的新靶点。
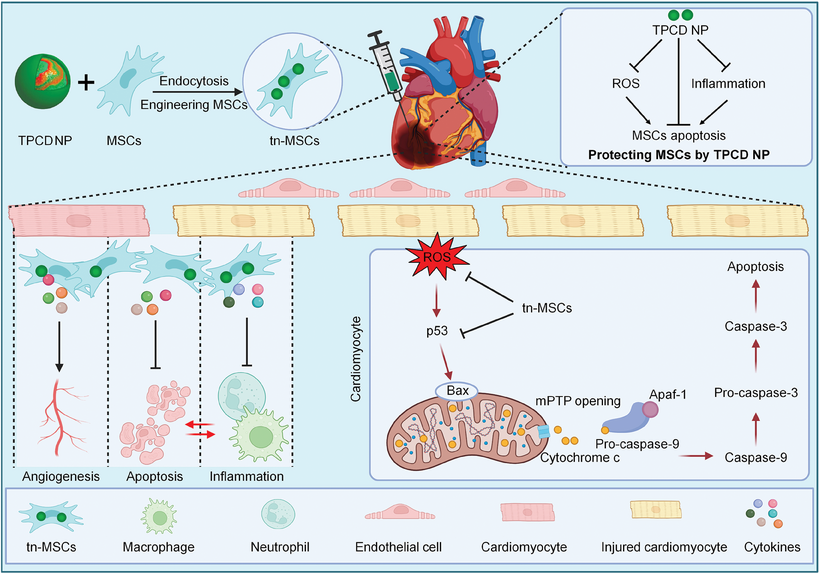
心肌梗死是冠状动脉疾病最严重的表现形式,是全球主要死亡原因之一。本研究报道了一种新型纳米治疗工程化方法,用于增强间充质干细胞(MSCs)对心肌缺血再灌注(MI/R)损伤的治疗效果。首先制备了一种抗氧化和抗炎症的纳米治疗剂(TPCD NP)。通过内吞作用成功将MSCs与TPCD NP工程化,且TPCD NP工程化不影响MSCs的干细胞特性。TPCD NP内化的MSCs(tn-MSCs)对活性氧簇(ROS)诱导的氧化应激、细胞毒性和凋亡具有抗性。在氧化应激条件下,tn-MSCs表现出比MSCs更强的旁分泌活性。相应地,tn-MSCs能有效增强病理条件下内皮细胞的血管生成。此外,tn-MSCs通过改善线粒体膜电位和调节p53信号通路,保护心肌细胞免受ROS诱导的细胞毒性和凋亡。在MI/R损伤小鼠中,与原始MSCs相比,tn-MSCs在受损心脏中的存活时间延长。相应地,tn-MSCs更显著地减少了梗死面积,改善了心脏功能,促进了MI/R损伤小鼠的心脏重塑。机制上,tn-MSCs通过减轻氧化应激和炎症、抑制心肌细胞凋亡及促进心脏修复来缓解MI/R损伤。因此,tn-MSCs有望用于治疗与氧化应激和炎症相关的心血管疾病。
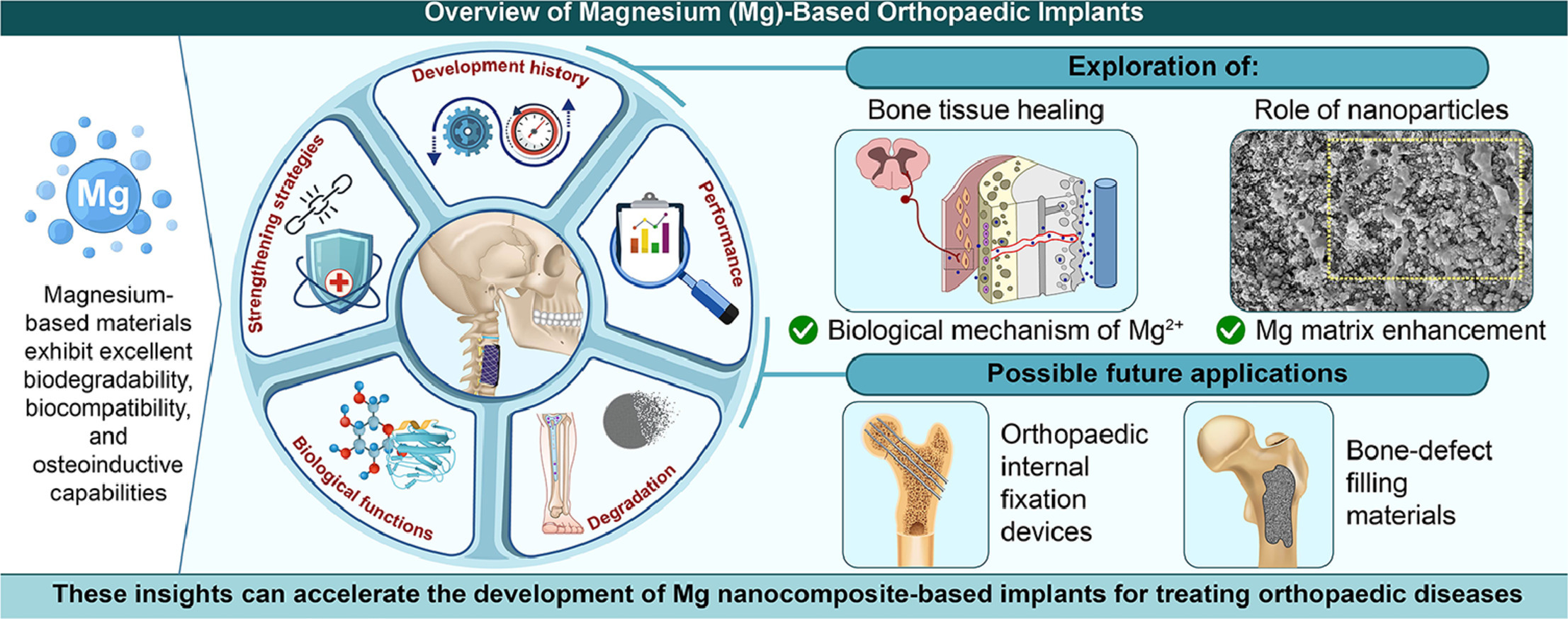
镁基材料因其良好的生物降解性、生物相容性和促进骨形成的特性,在骨科领域具有潜在的应用价值。然而,在早期应用过程中,其主要缺点是降解速率过快,这限制了其临床应用。纳米颗粒可以有效增强镁基体的机械强度和耐腐蚀性,而且可以选择不同的纳米颗粒来实现不同的生物学功能。因此,镁基纳米复合材料已经成为一类具有广泛临床应用潜力的可降解植入材料。本综述总结了镁基骨科植入物的研究进展,主要包括纳米颗粒对镁基材料的增强机制、不同纳米颗粒增强剂的作用和生物学功能、表面改性以及新制造技术的应用。此外,详细讨论了镁基材料的降解过程以及镁离子(Mg2+)在降解过程中的生物学功能。我们重点关注了Mg2+通过调节免疫微环境或多个信号通路促进骨和血管形成并抑制破骨细胞的生物学机制。最后,介绍了镁基骨科植入物的临床应用,并讨论了镁基纳米复合材料的未来研究方向。
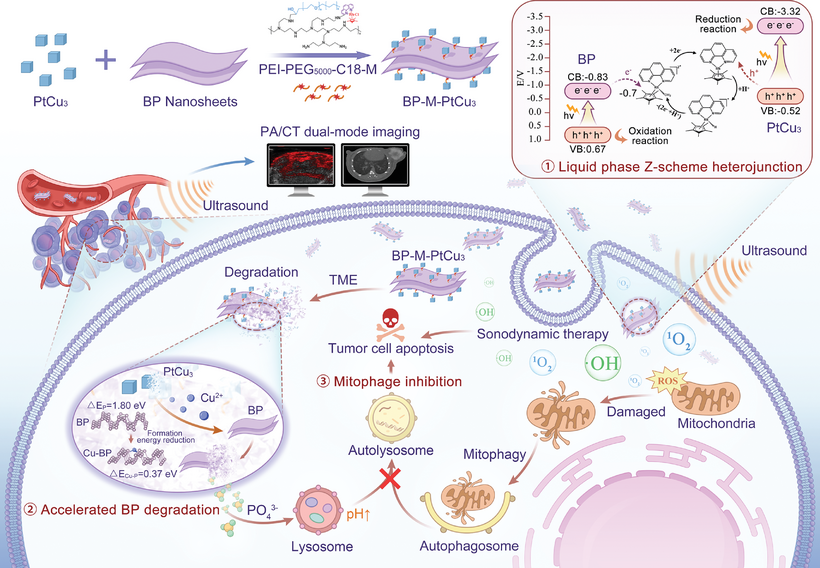
声动力治疗(SDT)作为一种有效的治疗手段,能够在肿瘤内产生有毒的反应性氧物种(ROS),用于对抗难治性三阴性乳腺癌(TNBC)。然而,由于癌细胞通过线粒体自噬机制减少线粒体氧化损伤,其治疗效果受到限制。本文报告了一种“全能”肿瘤治疗策略,将纳米声敏剂增强的非侵入性SDT与自噬抑制相结合。该策略通过合理构建声激活液体Z型异质结实现,该异质结通过两种声敏剂PtCu3纳米笼和抑制自噬的BP纳米片,通过亲水性有机连接物(PEI-PEG5000-C18)连接。共轭的电子介体(M,Cp*Rh(phen)Cl)被战略性地放置在两个声敏剂之间,以促进电子转移。基于M的Z型异质结结构延长了声激活电子-空穴对的分离时间,在超声刺激下实现高效的ROS生成。更重要的是,PtCu3释放的Cu2+通过减少磷空位形成能,加速BP降解,改善BP-M-PtCu3的生物降解性,并促进磷酸根离子的生成。这些离子提升了溶酶体pH值,抑制了受损线粒体在自噬溶酶体中的水解,从而防止癌细胞在氧化应激下自我保护,并有效消除TNBC。相信基于M的声激活Z型异质结将成为一种有前景的声敏剂结构,而声动力性自噬抑制策略为癌症治疗提供了宝贵的前景。
口服纳米药物为癌症免疫治疗提供了一条理想的途径,但其疗效受到胃肠吸收挑战、肿瘤生理病理屏障和免疫逃逸机制的限制。在本研究中,我们提出了一种新策略,将口服跨细胞运输的多柔比星(DOX)纳米药物与组蛋白去甲基化酶抑制剂5-羧基-8-羟基喹啉(IOX1)结合,从而实现协同化疗免疫治疗。我们证明,IOX1显著增强了DOX负载的聚(2-(N-氧化-N,N-二乙氨基)乙基甲基丙烯酸酯)-聚(ε-己内酯)纳米胶束(OPDOX)的跨细胞运输能力,促进其通过不同细胞屏障(绒毛上皮、内皮和肿瘤细胞)的运输,从而改善口服吸收、血管外渗透和肿瘤渗透。此外,IOX1能够敏感化化疗,增强DOX诱导的免疫原性细胞死亡,并下调程序性细胞死亡配体1(PD-L1),破坏免疫检查点机制,协同增强强效的抗肿瘤免疫反应。因此,口服给药的OPDOX与IOX1联合使用能够有效抑制CT26肿瘤生长,展示了增强口服纳米药物在癌症化疗免疫治疗中的疗效的巨大潜力。
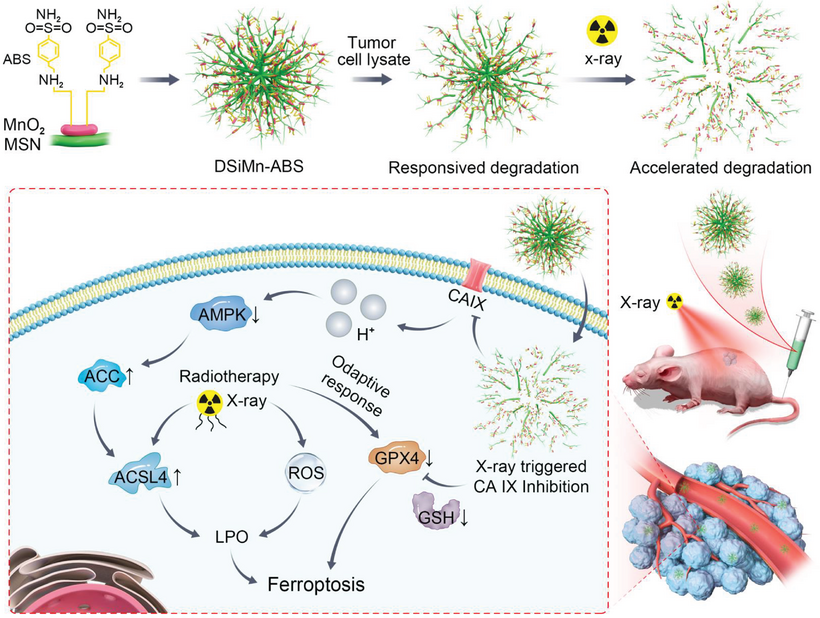
放射治疗诱导的铁死亡伴随着肿瘤细胞铁死亡抑制基因表达的适应性反应。本研究构建了一种可降解的、原位生成的硅锰复合系统,负载碳酸酐酶(CA IX)抑制剂(4-(2-氨基乙基)苯磺酰胺(ABS)),形成DSiMn-ABS纳米系统,以提高缺氧肿瘤细胞的铁死亡敏感性并改善放射治疗效果。该系统可在肿瘤环境和X射线下持续降解,释放二氧化锰(MnO2)和ABS;从而抑制CA IX活性,诱导肿瘤细胞内酸化,调节AMP活化蛋白激酶(AMPK)/乙酰辅酶A羧化酶(ACC)轴以增加肿瘤细胞对铁死亡的敏感性,并通过MnO2影响谷胱甘肽过氧化物酶4(GPX4)活性来消耗谷胱甘肽(GSH),进一步抑制肿瘤细胞的铁死亡防御系统,最终有效提高放射治疗效率。研究表明该系统可以有效抑制肿瘤生长,为肿瘤放射治疗提供了新的双重敏化策略。
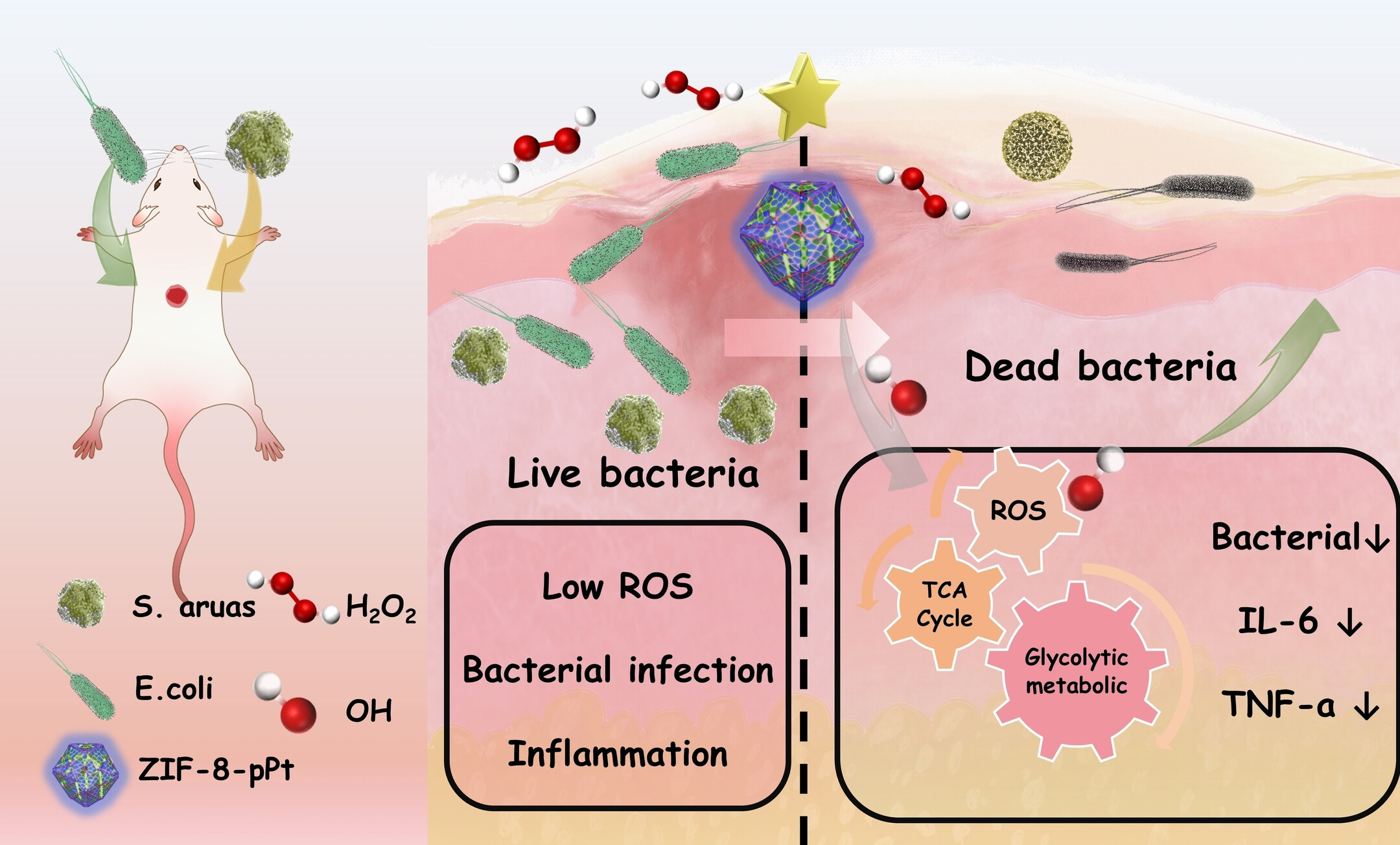
全球细菌感染危机因微生物抗生素耐药性的不断升级而加剧。纳米酶承诺提供巧妙的解决方案。在这里,我们报告了一种均匀的催化结构,即具有精细调节的金属-有机框架(ZIF-8)通道结构的铂(Pt)纳米簇,用于治疗感染性伤口。催化位点归一化显示,具有精细孔隙修饰结构的Pt聚集体结构的活性位点具有14.903×10^5 min^-1的催化能力,比ZIF-8中单分散状态下Pt颗粒的催化能力(0.793×10^5 min^-1)高出18.7倍。原位测试揭示了纳米酶界面上过氧化氢从均裂到异裂的变化是提高纳米酶活性的关键原因之一。密度泛函理论和反应界面的动力学模拟共同决定了催化中心和底物通道的作用。代谢组学分析表明,开发的纳米酶与活性氧物种协同工作,可以有效阻断细菌内的能量代谢途径,导致自发性凋亡和细菌破裂。这项开创性的研究为人工酶活性的调节提供了新思路,并为开发高效的抗生素替代品提供了新的视角。
