
鉴于骨折的自愈能力有限且难以根除感染,管理骨折感染是创伤骨科的一项重大挑战。在这项研究中,Cu2MoS4 纳米颗粒 (CMS) 具有制备的酶样活性以及 pH 值和近红外 (NIR) 光响应性。这些 CMS 与甲基丙烯酸明胶 (GelMA) 结合,合成具有抗菌和骨组织修复促进能力的 CMS 水凝胶 (CMSs@Gel)。体外和体内实验表明,CMSs@Gel具有良好的生物相容性;过氧化物酶样 (POD)、氧化酶样 (OXD) 和过氧化氢酶样 (CAT) 活性;优异的光热转换效率;和免疫调节能力。此外,CMSs@Gel表现出缓慢的降解,使其能够发挥不同的 pH 响应酶活性,并在整个处理过程中调节活性氧 (ROS) 的产生和巨噬细胞的极化。值得注意的是,这些效果在近红外 (NIR) 光下会显著增强。此外,在 NIR 照射下,CMSs@Gel将骨折环境维持在温和的温度 (40–42 °C),促进成骨和血管生成。综上所述,该CMSs@Gel增强骨折感染期间的杀菌活性,有效促进感染控制后骨折愈合,提供长期治疗效果。本研究为未来骨折感染的分期和长期治疗提供了强有力的理论基础。
周围神经缺损带来了复杂的骨科挑战,临床干预的效果有限。神经支架内雪旺细胞的增殖不足和功能障碍阻碍了神经修复的有效性。我们以前的研究表明镁封装的生物活性水凝胶在修复神经缺损方面的有效性。然而,其镁离子的快速释放限制了其对长期神经再生的功效,其分子机制仍不清楚。本研究利用静电纺丝技术制备了用于周围神经再生的 MgO/MgCO3/聚己内酯 (PCL) 多梯度纳米纤维膜。我们的研究结果表明,通过仔细调整可快速降解的 MgO 和可缓慢降解的 MgCO3 的浓度或比例,以及静电纺丝层的数量,多梯度支架在 6 周内有效地维持了 Mg2+ 的释放。此外,本研究提供了对 Mg2+ 诱导神经再生机制的见解,并证实 Mg2+ 有效促进雪旺细胞增殖、迁移和向修复表型的转变。通过采用转录组测序技术,该研究确定了 Wingless/integrase-1 (Wnt) 信号通路是神经再生过程中影响雪旺细胞功能的关键机制。植入大鼠 10 mm 临界大小的神经缺损后,MgO/MgCO3/PCL 多梯度纳米纤维结合 3D 工程 PCL 神经导管术后 12 周显示肌肉组织的轴突再生、髓鞘再生和神经再神经支配增强。 综上所述,本研究成功开发了一种具有可调 Mg2+ 释放特性的创新型多梯度长效 MgO/MgCO3/PCL 纳米纤维,强调了镁包埋生物材料治疗神经系统疾病的分子机制,为未来的临床转化奠定了坚实的理论基础。
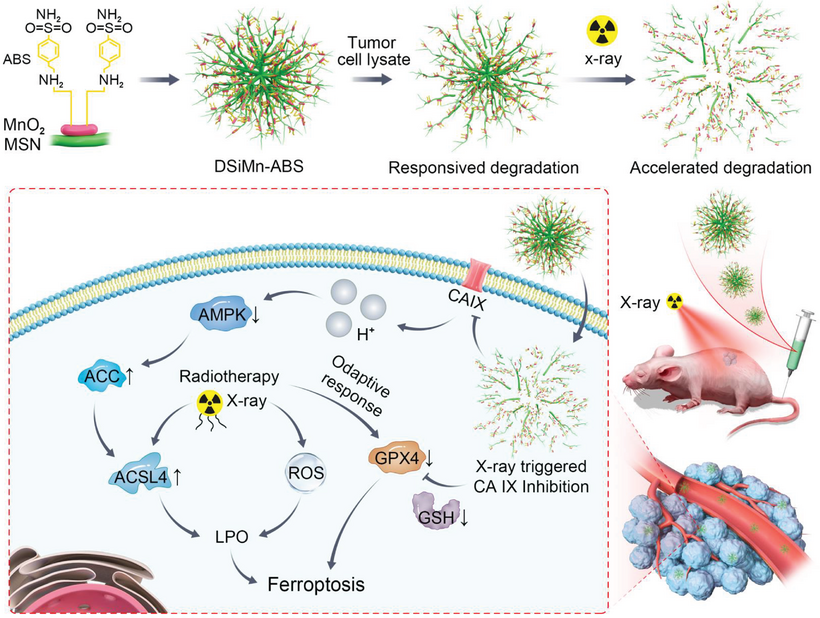
放射治疗诱导的铁死亡伴随着肿瘤细胞铁死亡抑制基因表达的适应性反应。本研究构建了一种可降解的、原位生成的硅锰复合系统,负载碳酸酐酶(CA IX)抑制剂(4-(2-氨基乙基)苯磺酰胺(ABS)),形成DSiMn-ABS纳米系统,以提高缺氧肿瘤细胞的铁死亡敏感性并改善放射治疗效果。该系统可在肿瘤环境和X射线下持续降解,释放二氧化锰(MnO2)和ABS;从而抑制CA IX活性,诱导肿瘤细胞内酸化,调节AMP活化蛋白激酶(AMPK)/乙酰辅酶A羧化酶(ACC)轴以增加肿瘤细胞对铁死亡的敏感性,并通过MnO2影响谷胱甘肽过氧化物酶4(GPX4)活性来消耗谷胱甘肽(GSH),进一步抑制肿瘤细胞的铁死亡防御系统,最终有效提高放射治疗效率。研究表明该系统可以有效抑制肿瘤生长,为肿瘤放射治疗提供了新的双重敏化策略。
脊髓损伤(SCI)后,巨噬细胞迅速激活并向M1表型极化,抑制M1样巨噬细胞已成为一种有前景的SCI治疗方法。金属调节蛋白能够高亲和力和特异性地感知特定金属离子,在免疫调节中发挥关键作用。在此,我们筛选了与金属调节蛋白相关的各种生物活性金属离子,发现Zn2+和Mn2+能有效抑制M1极化。基于这些发现,我们开发了由Zn2+与Mn2+配位自组装形成的弱碱性ZnMn基层状双氢氧化物(ZnMn-LDHs)来抑制M1样巨噬细胞。ZnMn-LDHs有效中和酸性环境并促进金属调节蛋白的表达,包括金属硫蛋白(MT)、超氧化物歧化酶1(SOD1)和超氧化物歧化酶2(SOD2),从而产生强大的M1样巨噬细胞抑制作用。更重要的是,巨噬细胞在ZnMn-LDHs调节后释放的神经生长因子(NGF)促进了雪旺细胞的延伸和铺展。通过将ZnMn-LDHs与丝素蛋白(SF)整合,构建了用于SCI修复的ZnMn@SF注射型水凝胶。体内动物模型进一步揭示了ZnMn@SF水凝胶在治疗SCI时的优异抗炎效果,促进了功能恢复。我们的研究结果强调了金属离子调节的金属调节蛋白在抑制M1样巨噬细胞中的重要性,为SCI治疗提供了一种有前景的治疗策略。
基于信使 RNA (mRNA) 的疗法已成为治疗各种疾病的革命性策略。在类风湿性关节炎 (RA) 等自身免疫性疾病中,靶向 mRNA 递送提供了一种潜在的干预来调节免疫反应。然而,在 B 细胞上实现免疫调节因子(例如抑制性 Fc γ 受体 FcγRIIB)的特异性和有效体内调节仍然具有挑战性。在这项研究中,由 AMB-POC18 脂质和聚(乙二醇)-嵌段-聚丙交酯 (PEG-PLA) 配制的脂质聚合物纳米颗粒 (LPN) 被设计为将 FcγRIIB mRNA (mFcγRIIB) 特异性递送到脾 B 细胞进行 RA 治疗。蛋白电晕分析表明,补体 C3 在 LPN 表面的选择性吸附促进了它们靶向递送至脾脏,提高了静脉内给药后 B 细胞的传染效率。在胶原诱导的关节炎小鼠模型中,mFcγRIIB/LPNs 有效地上调了脾 B 细胞中 FcγRIIB 的表达,显著降低了自身免疫反应并缓解了 RA 症状。进一步的机制研究阐明,FcγRIIB 表达增加通过 FcγRIIB/Lyn/SHP-1 信号通路抑制 B 细胞活化。这项工作强调了脾靶向 mRNA 递送系统用于 RA 治疗的潜力,提供了一种精确和靶向的方法来调节 B 细胞活性和减轻自身免疫性疾病。
免疫细胞和神经血管单位之间的串扰在中枢神经系统 (CNS) 损伤后的神经再生中起着关键作用。维持大脑免疫稳态对于恢复神经血管功能至关重要。本研究通过免疫调节水凝胶微球开发了一个交互式桥梁,以链接小胶质细胞与神经血管单位之间的相互作用网络,从而精确调节免疫-神经血管串扰并实现神经功能恢复。该免疫调节串扰微球 (MP/RIL4) 由小胶质细胞靶向 RAP12 肽修饰的白细胞介素-4 (IL-4) 纳米颗粒和硼酯官能化水凝胶组成,使用生物素-亲和素反应和空气-微流控技术。我们证实免疫调节微球降低了小胶质细胞中促炎因子(包括 IL-1β、iNOS 和 CD86)的表达,同时上调了 IL-10、Arg-1 和 CD206 等抗炎因子的水平。此外,注射 MP/RIL4 显着减轻了缺血性中风小鼠模型中的脑萎缩体积,促进了神经行为恢复,并增强了免疫细胞与神经血管单位之间的串扰,从而增加了中风小鼠的血管生成和神经发生。总之,免疫调节微球能够协调免疫细胞和神经血管单位之间的相互作用,对缺血性中风和其他 CNS 疾病具有相当大的治疗潜力。
生物活性分子在调节各种骨形成过程中显示出巨大潜力,使其成为骨再生的理想治疗选择。然而,生物活性分子的广泛应用受到体内低蓄积和短半衰期的限制。水凝胶作为理想载体已经崭露头角,可以解决这些挑战,具有延长病变部位滞留时间、延长体内半衰期、减轻副作用、避免突释和促进生理条件下吸收等潜力。本综述系统总结了生物活性分子负载水凝胶在骨再生领域的最新进展,包括颅骨缺损修复、股骨缺损修复、牙周骨再生和伴有基础疾病的骨再生等应用。此外,本综述讨论了通过刺激响应递送、载体辅助递送和序贯递送等策略改善生物活性分子释放特性的现有策略。最后,本综述阐明了水凝胶包封生物活性分子在骨再生领域面临的现有挑战和未来发展方向。
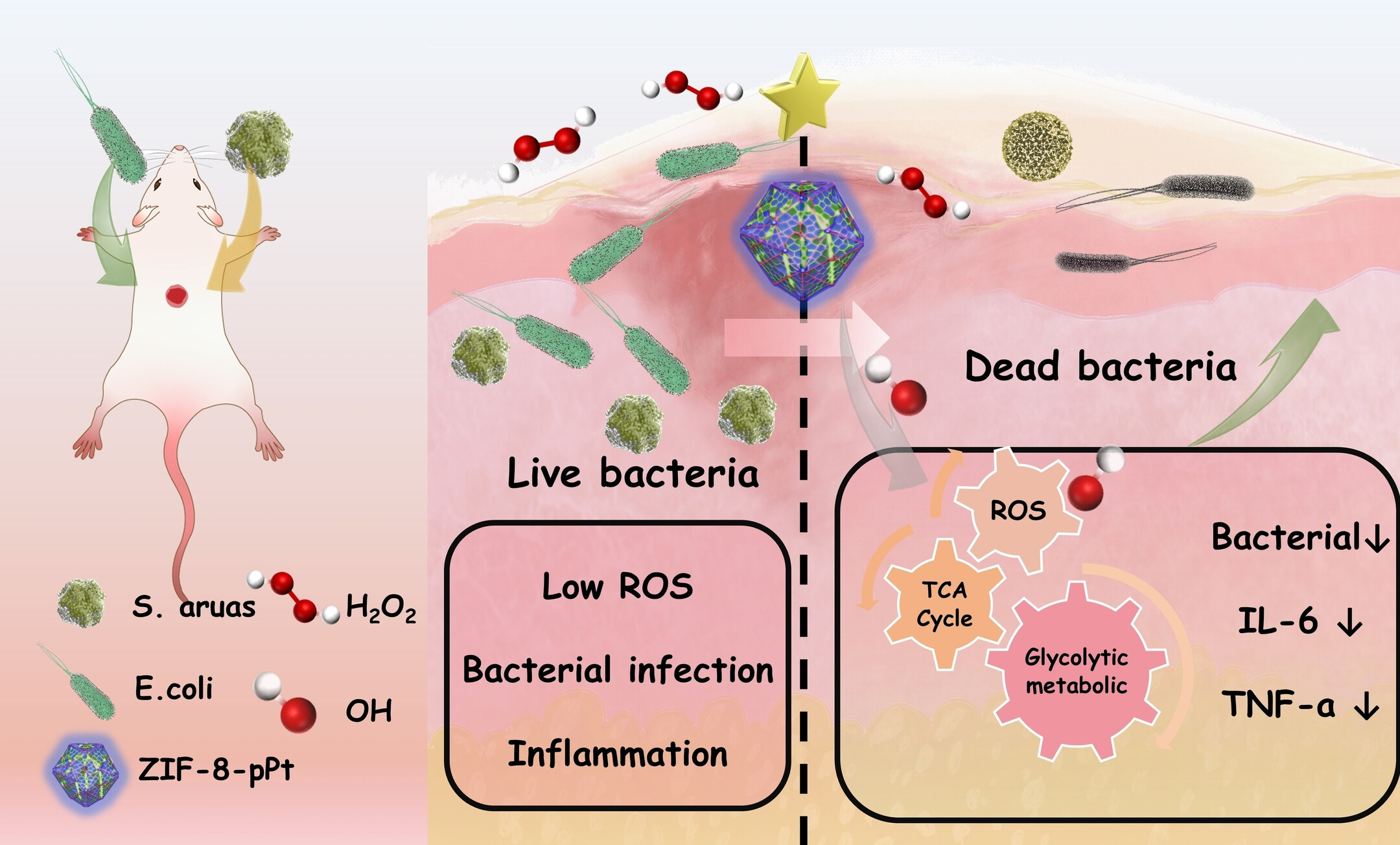
全球细菌感染危机因微生物抗生素耐药性的不断升级而加剧。纳米酶承诺提供巧妙的解决方案。在这里,我们报告了一种均匀的催化结构,即具有精细调节的金属-有机框架(ZIF-8)通道结构的铂(Pt)纳米簇,用于治疗感染性伤口。催化位点归一化显示,具有精细孔隙修饰结构的Pt聚集体结构的活性位点具有14.903×10^5 min^-1的催化能力,比ZIF-8中单分散状态下Pt颗粒的催化能力(0.793×10^5 min^-1)高出18.7倍。原位测试揭示了纳米酶界面上过氧化氢从均裂到异裂的变化是提高纳米酶活性的关键原因之一。密度泛函理论和反应界面的动力学模拟共同决定了催化中心和底物通道的作用。代谢组学分析表明,开发的纳米酶与活性氧物种协同工作,可以有效阻断细菌内的能量代谢途径,导致自发性凋亡和细菌破裂。这项开创性的研究为人工酶活性的调节提供了新思路,并为开发高效的抗生素替代品提供了新的视角。
溶瘤病毒在癌症治疗中具有潜在的应用。但是,其临床应用受到与病毒相关的生物安全性问题的限制。在此,受到水泡性口腔炎病毒基质蛋白(VSVMP)在溶瘤性水泡性口腔炎病毒(VSV)诱导的细胞凋亡中的关键作用的启发,设计了靶向纳米颗粒递送的中性VSVMP基因制剂,使其像VSV一样用于癌症治疗。该VSVMP配方由CRGDKGPDC肽修饰的杂化单甲氧基聚(乙二醇)-聚(d,l-丙交酯)纳米颗粒与VSVMP复合而成质粒,具有良好的血液相容性和肿瘤靶向能力。转染效率与VSV一样高。静脉给药后,VSVMP制剂可以有效地靶向肿瘤,显着抑制黑色素瘤的生长和转移,延长荷瘤小鼠的存活时间,并且不会引起明显的全身毒性。抗癌机制涉及凋亡诱导,血管生成抑制和一些与病毒相关的信号通路激活。这项工作证明了受VSV启发的非病毒基因疗法在黑素瘤治疗中具有广阔的临床应用前景。
肝母细胞瘤是最常见的儿科肝癌,几乎总是携带 WNT 激活的 CTNNB1 突变,但表现出显着的分子异质性。为了表征这种异质性并确定新的靶向疗法,我们使用单细胞 RNA-seq/ATAC-seq、空间转录组学和高通量药物分析对肝母细胞瘤和肿瘤衍生的类器官进行全面分析。我们确定了两个不同的肿瘤上皮特征:肝脏“胎儿”和 WNT 高“胚胎”,显示出不同的 WNT 信号模式。胎儿组富集肝脏特异性 WNT 靶标,而胚胎组富集经典 WNT 靶基因。基因调控网络分析显示,在胎儿亚型中,与胆汁酸、脂质和外源性代谢等肝功能相关的调节子富集,但在胚胎亚型中则不然。此外,转录因子 HNF4A 和 LEF1 的二分类表达模式允许明确区分胎儿和胚胎肿瘤细胞。我们还使用患者来源的肿瘤类器官进行高通量药物筛选,并确定对 HDAC 抑制剂的敏感性。有趣的是,胚胎和胎儿肿瘤类器官分别对 FGFR 和 EGFR 抑制剂敏感,表明肝母细胞瘤肿瘤发生依赖于 EGF/FGF 信号传导。总之,我们的数据揭示了肝母细胞瘤的分子和药物敏感性景观,并为靶向治疗的开发铺平了道路。
口腔鳞状细胞癌 (OSCC) 在手术和辅助治疗后仍经常侵袭性复发和转移,这是由原发肿瘤部位附近的术后残留癌细胞驱动的。一种植入式原位疫苗水凝胶被设计用于靶向肿瘤切除后残留的 OSCC 细胞。这种水凝胶用作 δ-氨基乙酰丙酸 (δ-ALA) 持续局部释放的储存库,增强原卟啉 IX 介导的光动力疗法 (PDT),以及用于光热疗法 (PTT) 的聚多巴胺-透明质酸复合物。此外,免疫佐剂,包括抗 CD47 抗体 (aCD47) 和 CaCO3 纳米颗粒,直接释放到切除的肿瘤床中。这种方法通过连续的近红外照射诱导残留 OSCC 细胞凋亡,促进钙干扰疗法 (CIT)。水凝胶进一步刺激免疫原性细胞死亡 (ICD),促进肿瘤相关巨噬细胞从 M2 到 M1 表型的极化。这促进了吞噬作用、树突状细胞活化、强大的抗原呈递和细胞毒性 T 淋巴细胞介导的细胞毒性。在小鼠 OSCC 模型中,原位疫苗可有效防止局部复发,抑制原位 OSCC 生长和肺转移,并提供针对肿瘤复发的长期保护性免疫。这些发现支持使用生物相容性水凝胶植入物进行术后原位疫苗接种,这是一种很有前途的策略,可以最大限度地减少残留肿瘤负荷并降低 OSCC 切除术后的复发风险。
阳性计算机断层扫描 (CT) 造影剂纳米剂在诊断肿瘤方面具有重要应用。然而,肝癌和正常肝组织之间的敏感区分仍然具有挑战性。出现这种挑战主要是因为正常的肝脏和肝癌组织都捕获了纳米制剂,导致类似的阳性 CT 造影剂。在这里,提出了一种融合阳性和阴性 CT 造影剂纳米剂的策略来检测肝瘤。纳米剂 Hf-MOF@AB@PVP 最初在肝脏中产生 120.3 胡 的阳性 CT 造影剂信号。随后,它可以特异性响应肝癌的酸性微环境生成 H2,进一步实现 -96.0 胡 的负对比。更重要的是,负信号区和阳性信号区之间的相对位置有助于确定肝癌和正常肝组织的位置。216.3 胡 的明显对比差异以及正常肝脏和肿瘤组织之间的相对方向对于利用 CT 成像敏感地区分肝癌和正常肝组织有意义。
