《Science》 顶刊最新发布:Pt-COF-Apt——用于肿瘤靶向的自增强光催化治疗
导读
共价有机框架(COF)已成为纳米医学的一个有前景的平台,但由于缺乏有效的 COF 修饰策略,开发多功能 COF 纳米平台仍然具有挑战性。在此,本文提出了一种用于COF功能化的纳米酶桥接(NZB)策略。作为过氧化氢酶模拟物的铂纳米颗粒(Pt NPs)原位生长在COF NPs的表面上,而不降低其载药能力(CP),并且硫醇封端的适体通过稳定的Pt-S键进一步致密地装饰到CP NPs上 (CPA)。Pt纳米酶工程和适体功能化使纳米平台具有优异的光热转换、肿瘤靶向和过氧化氢酶样催化性能。使用临床批准的光敏剂吲哚菁绿(ICG)作为模型药物,制造了用于肿瘤靶向自强化治疗的纳米系统(ICPA)。ICPA能够有效地积聚到肿瘤组织中,通过分解过度表达的H2O2并产生O2来缓解缺氧微环境。在单波长近红外光照射下,ICPA的类过氧化氢酶催化和单线态氧生成活性显着增强,从而以自我强化的方式对恶性细胞和荷瘤小鼠产生良好的光催化治疗效果。
图文参考
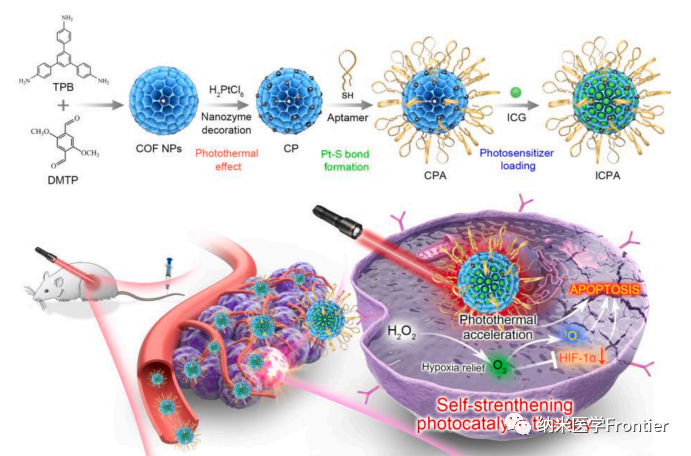
图1. ICPA的合成及其在单波长近红外光照射下以自我强化方式逆转肿瘤缺氧、诱导肿瘤热损伤和氧化应激的应用
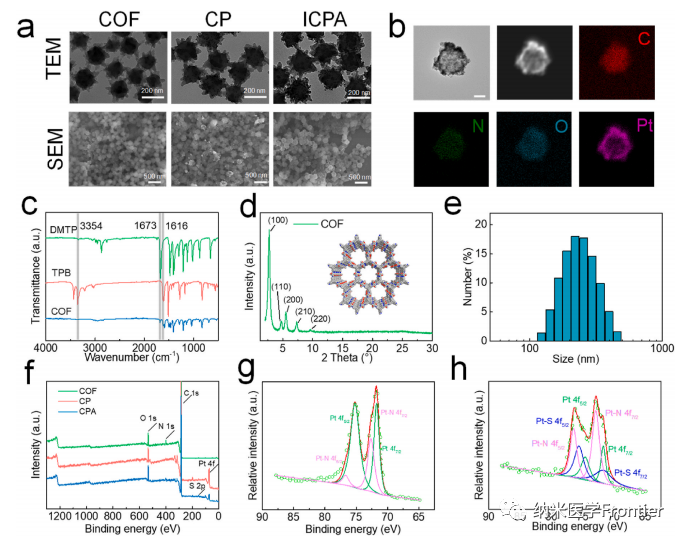
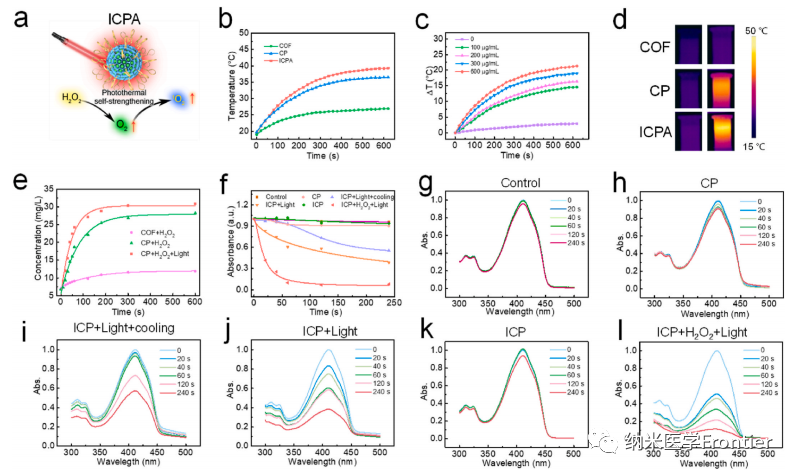
图3.(a)单波长近红外辐射下具有自增强方式的ICPA示意图。(b) 各种纳米粒子 (600 μg/mL) 在 808 nm 光照射 (1 W/cm2) 下的光热曲线和 (d) 光热图像。(c) 808 nm激光(1 W/cm2)下不同浓度ICPA的光热曲线。(e)通过溶氧仪测量不同处理的不同材料的产氧能力。(f)不同纳米颗粒引起的DPBF吸收衰减率。(g)–(l)不同处理后DPBF的紫外可见光谱。
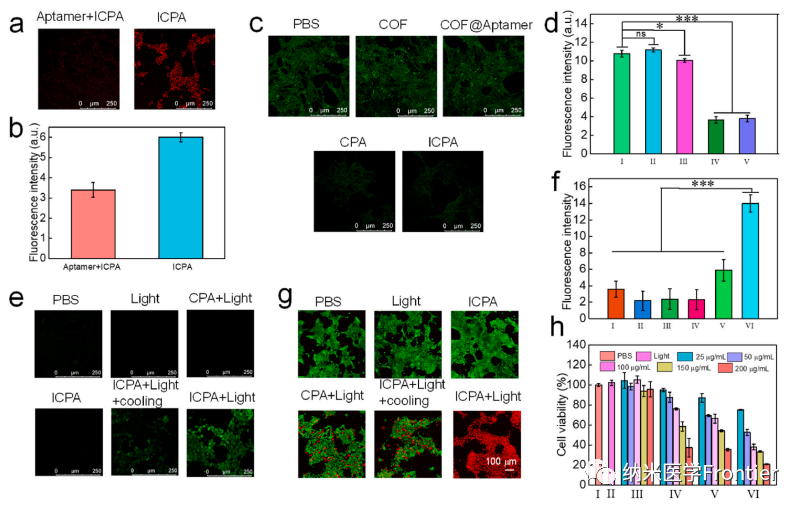
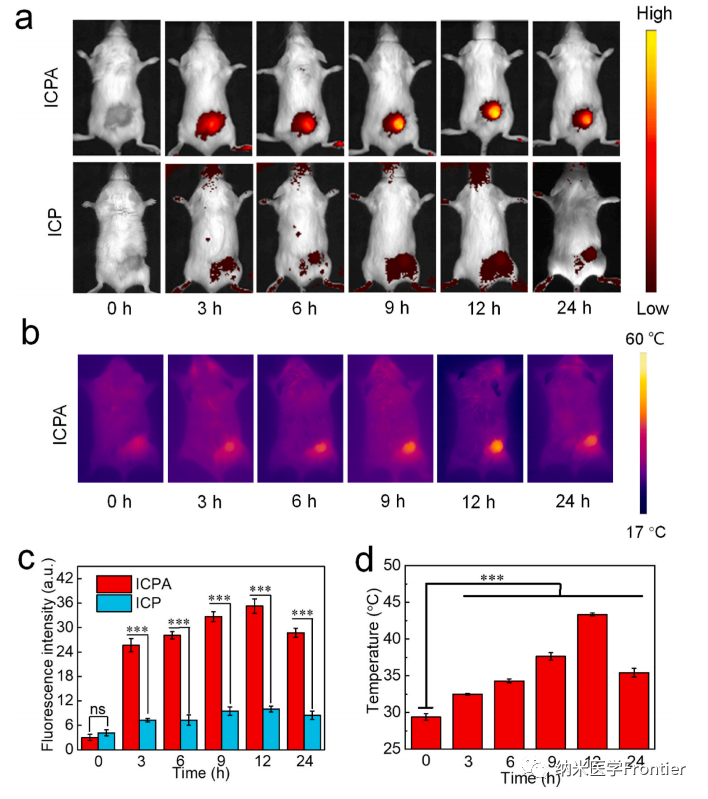
图5.(a)在不同时间点注射ICPA或ICP的4T1荷瘤小鼠的体内荧光成像和(c)(a)中肿瘤区域荧光强度的量化。(b)静脉注射ICPA后不同时间点小鼠的热图像和(d)(b)的温度量化。(*p < 0.05,**p < 0.01,***p < 0.001)。
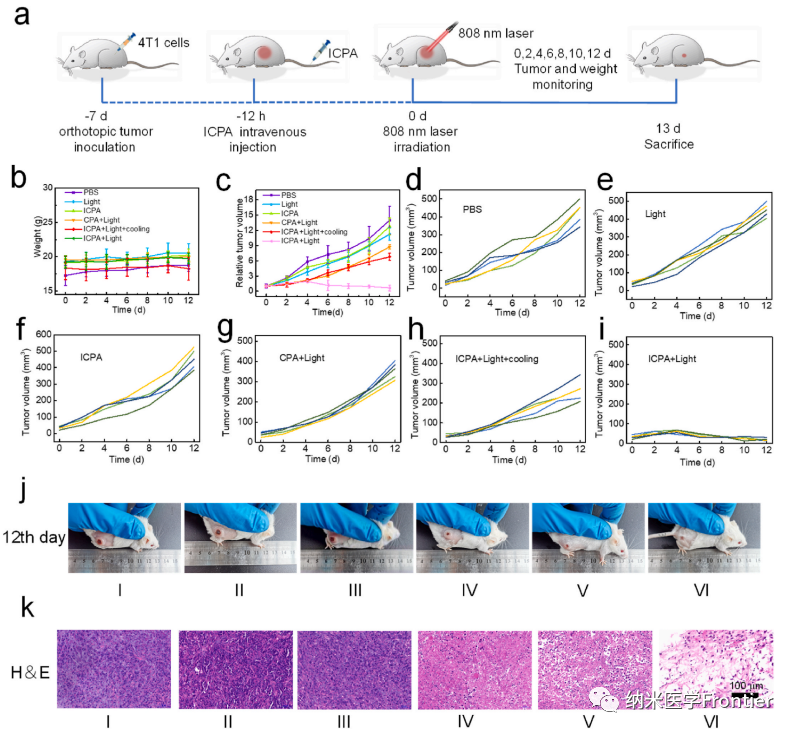
图6.(a)动物实验示意图。(b) 接受不同处理的小鼠12天内体重变化曲线。(c)不同组的相对肿瘤体积。(d–i) 不同治疗小鼠的肿瘤体积。(j)不同治疗后荷瘤小鼠的照片。(k)不同处理后肿瘤切片的H&E染色。(I,PBS;II,光;III,ICPA;IV,CPA + 光;V,ICPA + 光 + 冷却;VI,ICPA + 光)。
总结:
Pt-COF-Apt纳米平台具有良好的水溶性、稳定性、生物相容性和肿瘤靶向能力。在体外实验中,Pt-COF-Apt纳米平台能够有效地识别和杀死肿瘤细胞,表现出高效的光催化治疗效果。在体内实验中,Pt-COF-Apt纳米平台能够有效地聚集在肿瘤部位,产生大量的活性氧物种,从而抑制肿瘤的生长和转移。该实验证明了Pt-COF-Apt纳米平台作为一种新型的光敏剂,为肿瘤靶向的自增强光催化治疗提供了一种新的策略。光催化治疗是一种利用光敏剂在光照下产生活性氧物种,从而杀死肿瘤细胞的方法。该方法具有无创、高效、低毒性等优点,但也存在一些问题,如光敏剂的稳定性、选择性和光催化效率等。
创新点:
1.本研究制备了一种新型的纳米材料ICP,具有优异的光热转换能力和抗肿瘤药物负载能力,可用于肿瘤靶向的光热治疗。利用铂纳米酶桥接的共价有机框架(Pt-COF)作为光敏剂,与适配体(Apt)结合,形成Pt-COF-Apt纳米平台。
2. 评估了ICP的光热转换能力和抗肿瘤药物负载能力,发现其在近红外光照射下能够产生较高的温度,并可以有效地负载抗肿瘤药物。3. 评估了ICP的抗肿瘤效果,发现其在体外和体内实验中都能够有效地抑制肿瘤生长。
| 温馨提示:网站部分素材源自网络,仅供学术交流勿做其他用途,如有侵权请联系我们立即删除。苏州北科纳米供应产品仅用于科研,不能用于人体,不同批次产品规格性能有差异。 |
上一篇: 碳点新突破:清除ROS,生物成像


 苏公网安备32059002005573 苏ICP备2020067807号-1
苏公网安备32059002005573 苏ICP备2020067807号-1 