苏州大学殷黎晨AM:超支化聚(β-氨基酯)作为细胞溶质蛋白递送的通用平台

蛋白质疗法由于其药理效力和特异性而在疾病治疗方面具有巨大潜力。但是由于具有高分子量的亲水性蛋白质药物对细胞膜来说是不可渗透的,因此蛋白质疗法的临床可用性仅限于细胞外靶标。虽然现在人们提出具有细胞内靶向的蛋白质有着更好的治疗结果,但由于缺乏有效的细胞溶质的蛋白递送策略,细胞内蛋白质疗法的成功受到很大限制。
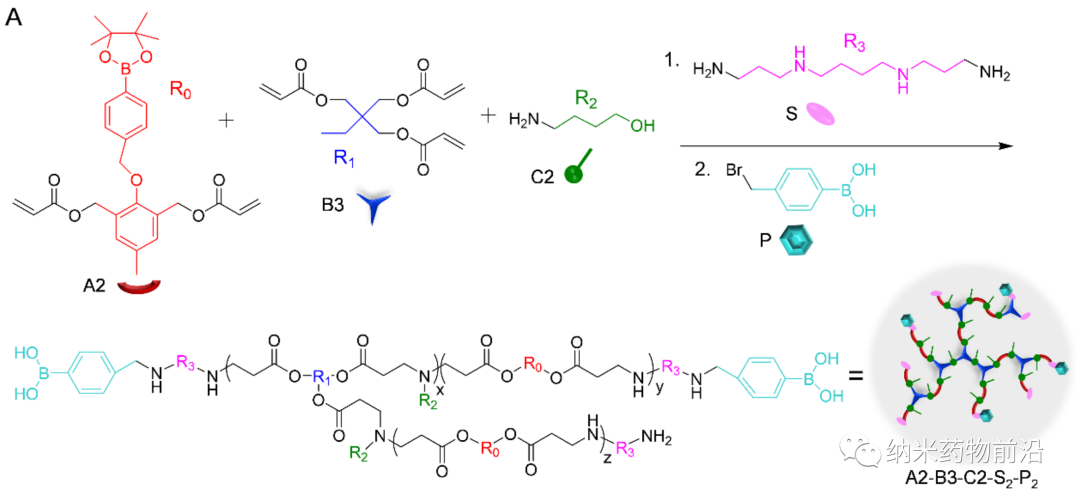
细胞溶质的蛋白递送是基于蛋白质的生物技术和细胞内靶标治疗的先决条件。其关键过程在于将蛋白质药物有效包封到细胞可摄取的纳米系统中。一个较为成熟的策略是使用纳米载体,如脂质体、聚合物囊泡、纳米胶囊,纳米乳液、介孔二氧化硅纳米粒子(MSNs)等将蛋白质药物装载在内水腔或孔道内。然而,这些方法通常具有局限性,例如复杂的合成、低蛋白质负载效率、需要纯化、蛋白质结构和生物活性的破坏等。另一种方法是将蛋白质与阴离子物质进行共价修饰,如羧酸,硼酸或其他阴离子蛋白质等,使得修饰的蛋白质可以通过静电相互作用与阳离子材料形成纳米复合物(NC)。虽然这些化学修饰的部分可通过细胞内的刺激因素去除,但常常影响蛋白质的生物活性。此外,也出现了聚合物介导的蛋白质的胞质递送。利用聚合物和蛋白质之间的氢键、疏水作用、金属配位作用、氮硼酸酯(N-B)配位作用等自组装形成稳定的NC。因此,各种聚合物,如富含胍的聚合物,富含硼酸的聚合物等已被设计用于胞质蛋白递送。但是由于结合力较强,会不可避免地延迟细胞内蛋白质释放并因此降低蛋白质活性。
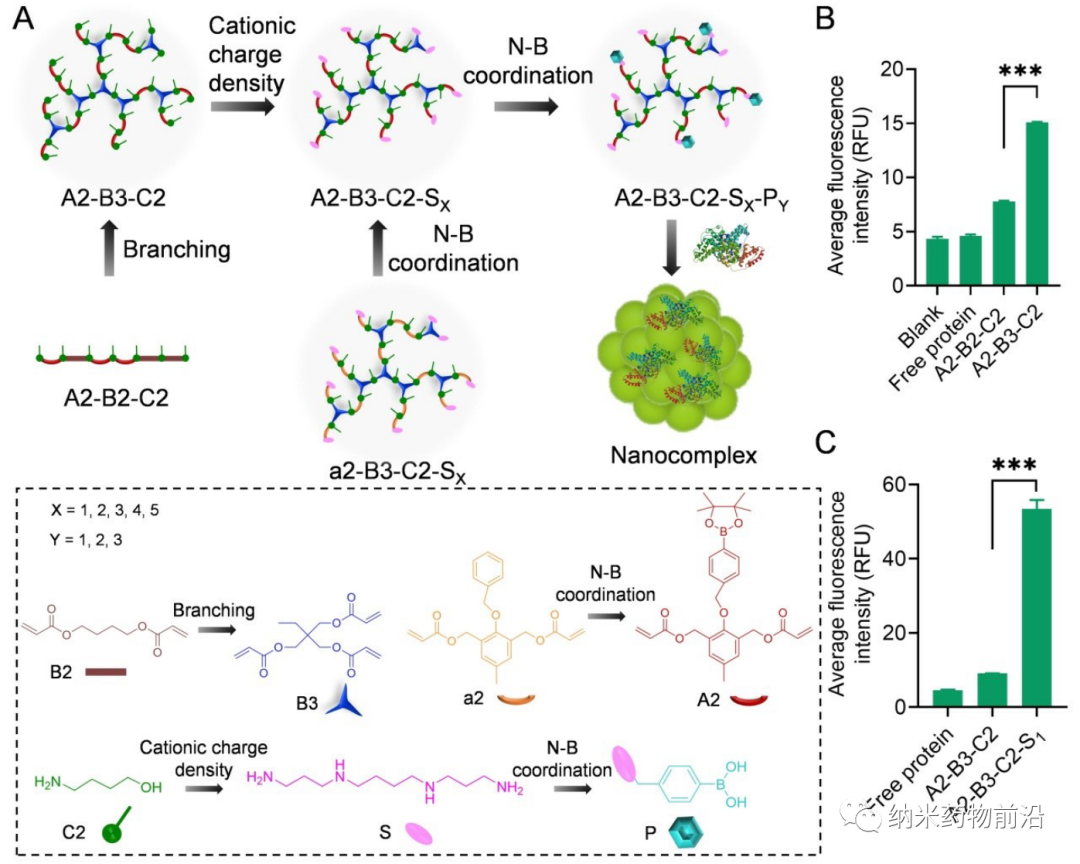

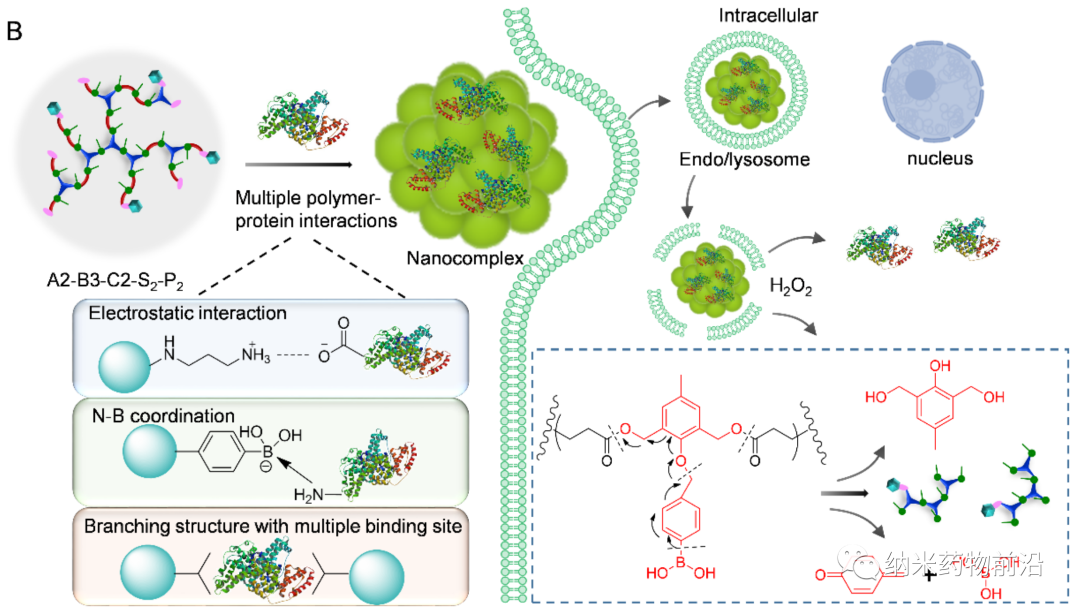
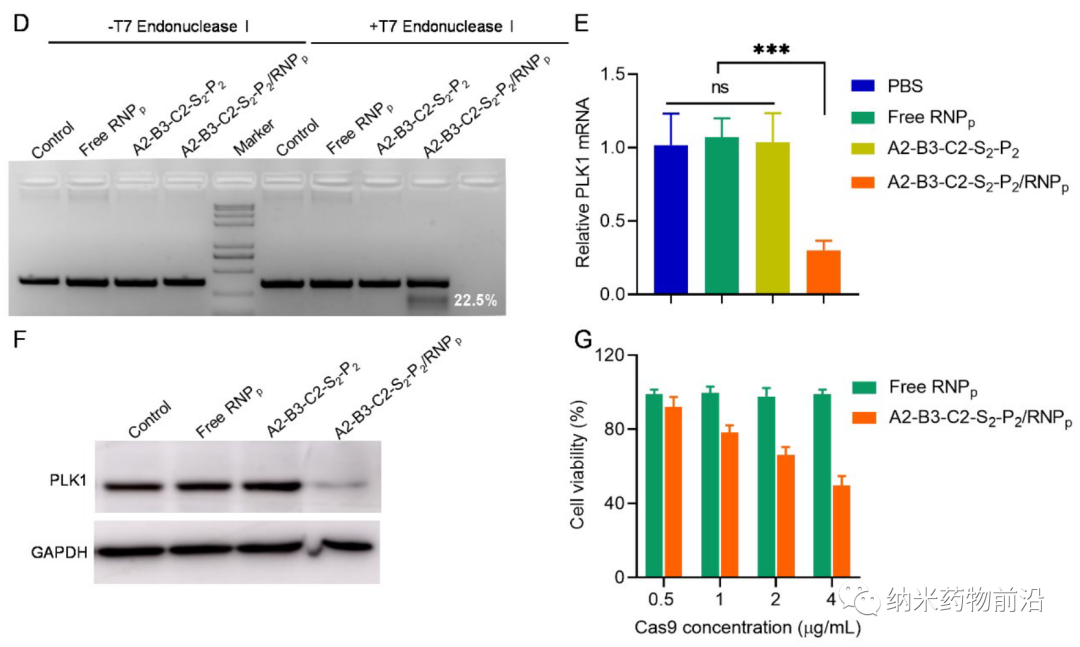
为了解决以上方法所带来的问题,苏州大学殷黎晨教授设计了基于ROS可降解的超支化聚(β-氨基酯)(HPAE)骨架接枝苯硼酸(PBA)的通用胞质蛋白递送平台。分支结构使得多价增强的蛋白质结合力成为可能,并且利用静电相互作用,通过精胺封端进一步增强蛋白质结合。骨架中的PBA通过N-B配位作用与蛋白质药物结合,并且额外使用PBA封端进一步增强了这种结合力。由于癌细胞可产生较多活性氧(ROS),如过氧化物、超氧化物、羟基自由基等。因此在癌细胞的细胞质中,骨架接枝的PBA被过量产生的H2O2氧化,引发聚合物快速降解并释放生物活性蛋白。实验表明,此策略可介导大量具有不同分子量和等电点的蛋白质或多肽向癌细胞的强力递送,包括酶、抗体、CRISPR-Cas9核糖核蛋白等,还能够在体内有效递送皂草素以引起显著的抗肿瘤功效。


原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202108116
| 温馨提示:网站部分素材源自网络,仅供学术交流勿做其他用途,如有侵权请联系我们立即删除。苏州北科纳米供应产品仅用于科研,不能用于人体,不同批次产品规格性能有差异。 |
下一篇: 纳米医学产品1


 苏公网安备32059002005573 苏ICP备2020067807号-1
苏公网安备32059002005573 苏ICP备2020067807号-1 