中山大学毛宗万Angew:锚定碳酸酐酶IX (CAIX)的铼(I)光敏剂引起焦亡增强抗肿瘤免疫

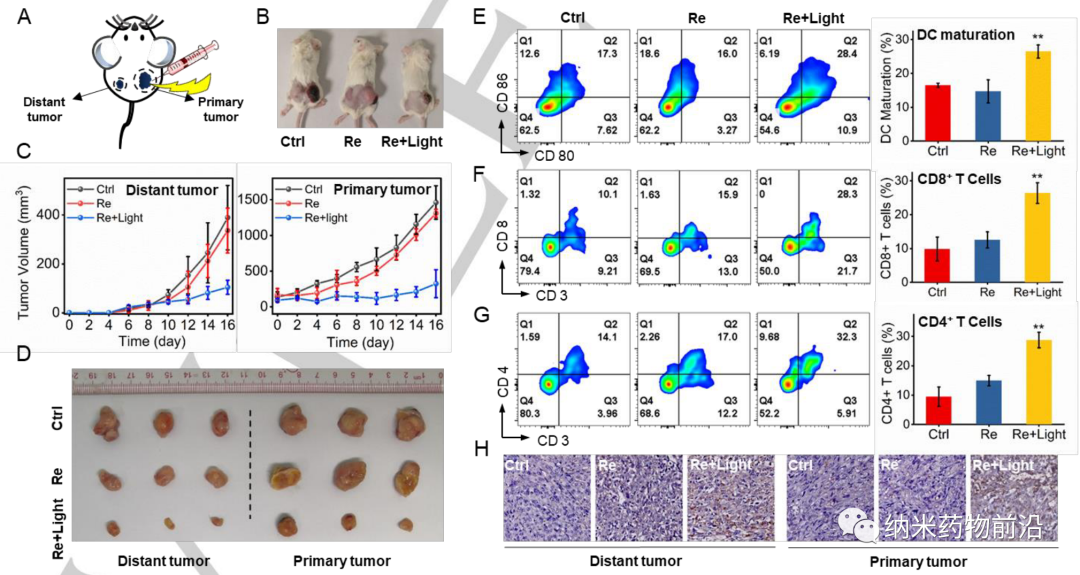
理想的肿瘤治疗既要破坏原发肿瘤,又要提高肿瘤微环境的免疫原性,以达到良好的抗肿瘤免疫效果。为此,中山大学毛宗万设计了一种锚定碳酸酐酶IX (CAIX)的铼(I)光敏剂,命名为CA-Re,不仅能在低氧下高效地进行I型和II型光动力治疗(PDT),而且可通过诱导gasdermin D (GSDMD)介导焦亡,有效刺激肿瘤免疫原性。CA-Re能同时破坏和自我报告膜完整性的丢失。促进树突状细胞(dendritic cells, DCs)的成熟和抗原呈递,并在体内充分激活T细胞依赖的适应性免疫反应,最终在消灭原发肿瘤的同时消灭远端肿瘤。而CA-Re是第一个基于金属络合物的焦亡诱导剂,这一研究为肿瘤的金属免疫治疗提供了一个新的角度。
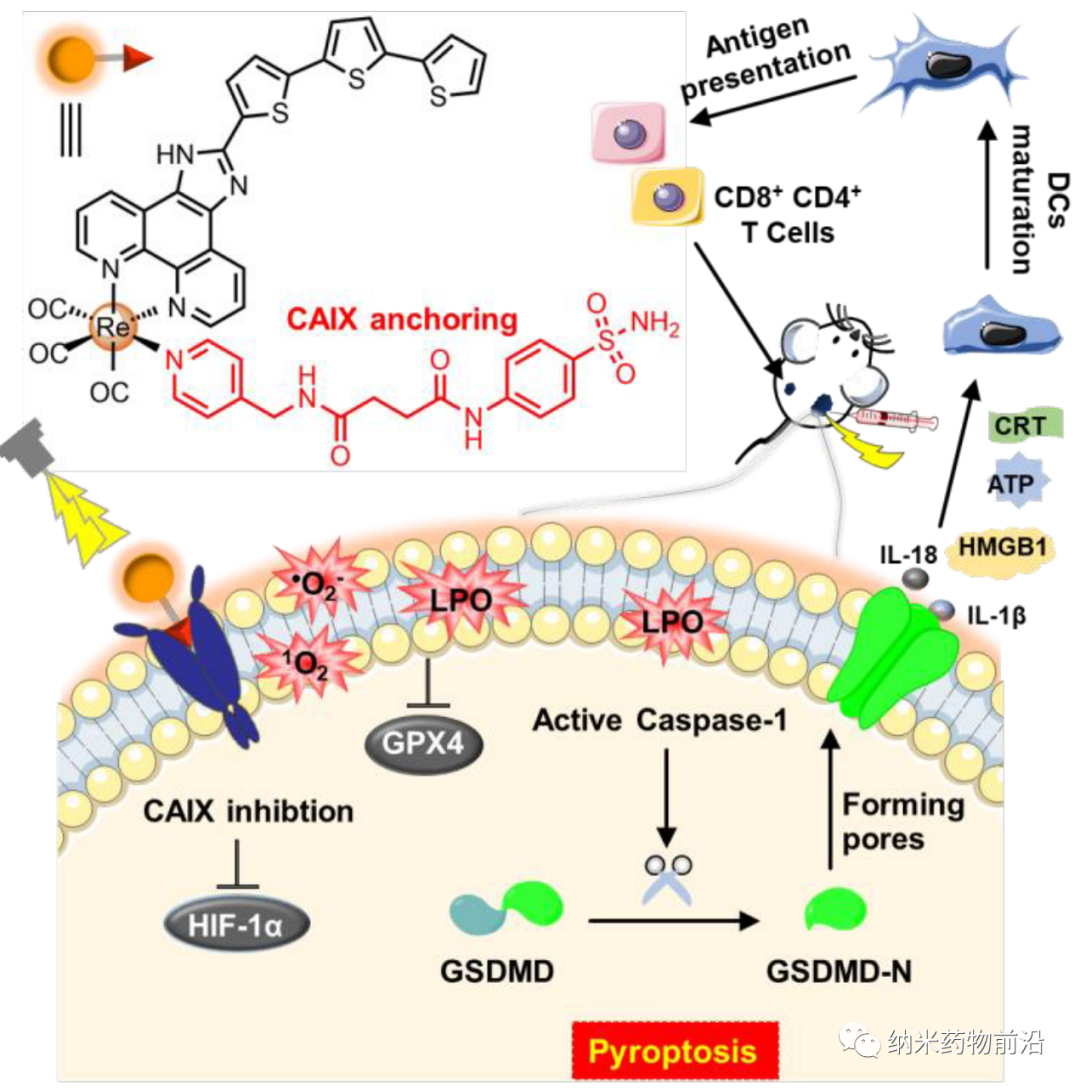
随着免疫检查点阻断疗法(ICB)在一些晚期癌症中的临床成功,免疫治疗引起了广泛的关注。然而,其对恶性肿瘤如三阴性乳腺癌(mTNBC)和结直肠癌的治疗效果受到非免疫原性肿瘤微环境的严重限制。近年来,有大量的证据表明光动力疗法(PDT)后会产生免疫刺激,提示它是一种潜在的免疫原性治疗方法。PDT是一种利用光和无毒光敏剂通过氧依赖途径(type-II)产生单线态氧(1O2),或通过氧不依赖途径(type-I)产生其他活性氧(ROS),以时间和空间选择性破坏肿瘤组织的无创临床治疗方法。在某些情况下,PDT可以诱导细胞释放损伤相关分子 (DAMPs),从而增强癌细胞的免疫原性并激活全身适应性免疫反应。然而,大多数光敏剂必须与ICB联合使用(如抗CTAL4、抗PD-L1)才能达到较好的抗肿瘤免疫效果,但成本高,副作用严重。其缺乏普遍性和有效性的原因主要在于: (1) 肿瘤缺氧严重限制了PDT的效率,促进了免疫抑制; (2) PDT通常诱导细胞凋亡,由于缓慢或甚至不释放DAMPs,其免疫原性较差。因此,为了实现有效的抗肿瘤免疫,迫切需要能够在缺氧条件下实现高PDT效率并以高免疫原性诱导细胞死亡而不是凋亡的新型光敏剂。细胞焦亡是一种独特的程序性细胞死亡形式。炎性caspases裂解gasdermin D (GSDMD)被认为是介导焦亡的关键事件,其释放N-末端结构域(GSDMD- N)与膜磷脂结合并在细胞膜上钻孔。结果,细胞膜的渗透电位被破坏,导致细胞肿胀、细胞膜破裂和炎症因子(如IL-1β、IL-18)的快速释放。研究发现,由焦亡引起的炎症反应能激发较强的抗肿瘤免疫,增强ICB的疗效。因此,焦亡为高免疫原性光敏剂的设计提供了新的方向。
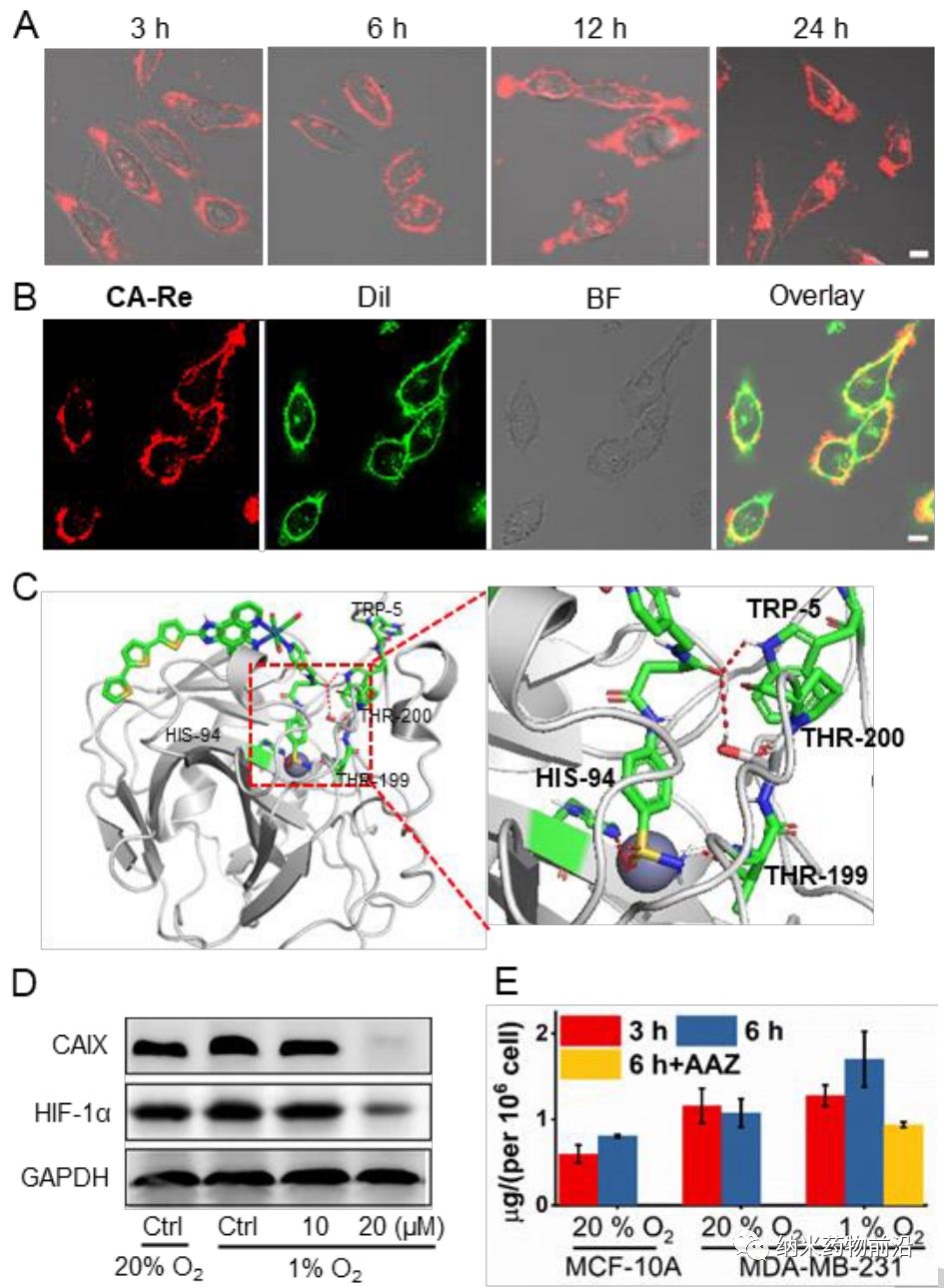
由于CAIX是一种跨膜蛋白,仅在肿瘤而非正常组织中过表达。其转录受缺氧诱导因子(HIF-1α)的调控。作者设计了一个含有苯磺酰胺尾部的吡啶基配体,这是CAIX结合锌活性中心常用的部分。然后将该单齿配体与脱氯的Re(CO)3(N^N)Cl前体在四氢呋喃中反应合成新型光敏剂CA-Re,然后通过柱层析(CH2Cl2/CH3OH)纯化。经表征和性质结果表明,CA-Re具有优良的光稳定性,即使辐照后也不释放吡啶配体。此外CA-Re拥有CAIX锚定和干预能力,使其能够固定在细胞膜上,在一定程度上缓解肿瘤缺氧。这促进了膜上原位ROS的产生和脂质的过氧化,最终在缺氧条件下表现出极高的PDT效率(纳摩尔水平的光毒性),并有效地引发gasdermin D介导的焦亡。在此过程中,CA-Re引起并自我报告细胞膜完整性的丧失。因此,一系列炎症因子和DAMPs在治疗部位迅速释放,刺激树突状细胞成熟和抗原提呈,最终在体内激活T细胞依赖的适应性免疫反应,在破坏原发肿瘤的同时抑制远端肿瘤的生长。
https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.202115800
本信息源自互联网仅供学术交流 ,如有侵权请联系我们立即删除。
| 温馨提示:网站部分素材源自网络,仅供学术交流勿做其他用途,如有侵权请联系我们立即删除。苏州北科纳米供应产品仅用于科研,不能用于人体,不同批次产品规格性能有差异。 |
下一篇: 纳米医学产品1


