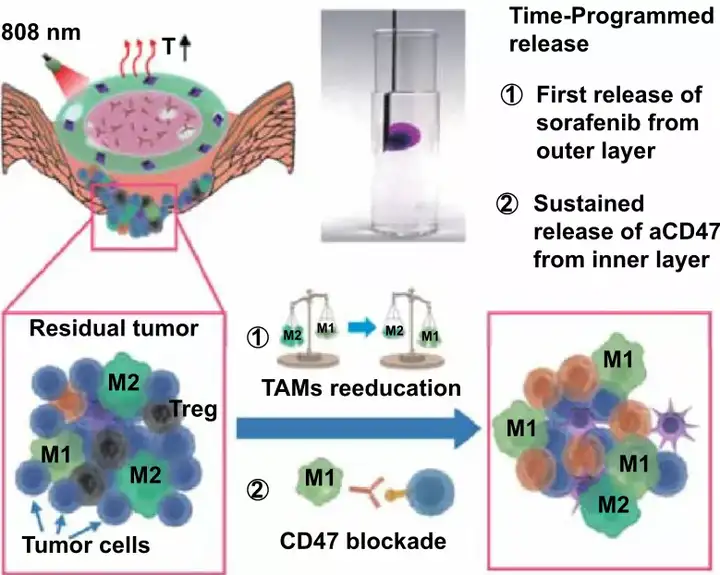
乳腺癌术后治疗:可注射双层凝胶实现索拉非尼和抗CD47抗体的贯序释放
乳腺癌细胞的高侵袭性以及手术切除后的高度免疫抑制微环境导致化疗、放疗以及免疫疗法等治疗方法效果受限。由于巨噬细胞具有可塑性,将促进肿瘤生长的M2型肿瘤相关巨噬细胞(Tumor-associated macrophages, TAMs)通过“再教育”为具有抗肿瘤活性的M1型,有望逆转术后免疫抑制微环境。此外,抗CD47抗体(aCD47)通过阻断CD47与信号调节蛋白α(SIRPα)的相互作用,能够激活吞噬细胞与效应T细胞介导的免疫应答,增强抗肿瘤疗效。因此,本研究提出假设:在CD47免疫阻断治疗之前,优先对肿瘤术后的TAMs进行再“再教育”,有望建立一个整体免疫有利的微环境,以提高抗肿瘤效果。
Time-Programmed Delivery of Sorafenib and Anti-CD47 Antibody via a Double-Layer-Gel Matrix for Postsurgical Treatment of Breast Cancer
Liping Huang, Yiyi Zhang, Yanan Li, Fanling Meng, Hongyu Li, Huimin Zhang, Jiasheng Tu, Chunmeng Sun*, Liang Luo*
Nano-Micro Letters (2021)13: 141
https://doi.org/10.1007/s40820-021-00647-x
本文亮点
1. 开发了一种新型可注射双层凝胶;
2. 分层结构的双层脂质凝胶可实现药物时间贯序释放;
3. 证实了优先释放适宜剂量的索拉菲尼能够对肿瘤相关巨噬细胞进行“再教育”并增强抗CD47抗体的效果。
内容简介
华中科技大学罗亮教授与中国药科大学孙春萌副教授联合团队在这项研究中构建了由不同比例的大豆卵磷脂/二油酸甘油酯组成的可注射双层凝胶,以实现贯序释药、逆转免疫微环境,并且结合免疫阻断疗法,从而更好地防止乳腺癌术后复发与转移。双层凝胶的外层具有热响应性,并负载吸附有索拉菲尼(SRF)的氧化石墨烯(GO)纳米粒子。GO在人工控制的近红外照射下产生较为温和的热量,首先刺激SRF的释放,对TAMs进行再“再教育”,促进免疫原性微环境的形成。内层凝胶负载aCD47,能够长时间维持凝胶状态,使得aCD47持续释放,阻断CD47与SIRPα通路,实现长期的抗肿瘤效果。体内4T1荷瘤小鼠模型研究表明,基于双层凝胶的贯序释药策略通过逆转局部免疫抑制,协同阻断CD47介导的免疫逃逸,能够增强全身免疫反应,有效地防止肿瘤复发与转移。
图文导读
I 双层凝胶的设计与表征
分别制备包封SRF@GO(SG)的外层凝胶前体和包封aCD47的内层凝胶前体,并分别装入双筒注射器中。如图1所示,依次注射后,可形成界限分明的双层凝胶。体内外光热性能考察结果显示,双层凝胶光热性能良好,升温随功率可调且2分钟之内便可达到所需温度。体外实验中外层包载SG,内层使用IgG模拟aCD47。
结果均表明能够实现良好的贯序释药,即外层通过光控释药优先释放,内层则长效缓释。体内实验中使用Ce6模拟SRF,AFIgG模拟aCD47,同样证明可实现贯序释药。
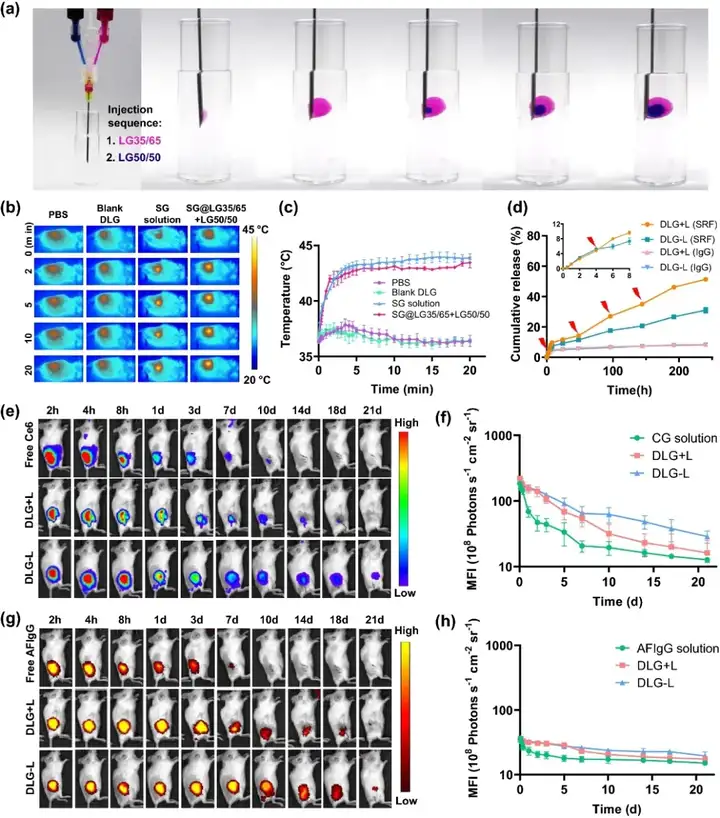
图1. (a) 使用双筒注射器形成双层凝胶示意图;(b, c) 4T1-luc荷瘤小鼠术后经PBS、Blank DLG、SG溶液和LG50/50+SG@LG35/65治疗后施加808 nm激光照射20分钟内温度变化情况(n=3);(d) 体外光控释放SRF和长效缓释IgG的累计释放量(n=3);(e, f) 小鼠体内荧光成像Ce6剩余情况(n=3);(g, h) 小鼠体内荧光成像AFIgG剩余情况(n=3)。
IISRF的最优释放方案筛选
SRF对巨噬细胞的调节和抗肿瘤疗效具有剂量依赖性,因此筛选最适合本研究的索拉菲尼释放方案对于免疫微环境的调节和肿瘤治疗至关重要。如图2所示,本研究控制不同组别药物剂量一致,即aCD47为70 μg/只,SRF为50 μg/只。通过改变内外层凝胶体积比、光照时间与光照频率,从而改变内外层凝胶的释放速率,以筛选调节肿瘤免疫微环境(Tumor microenvironment, TME)的最优方案。最终确定内外层凝胶各50 μL,于第0天、2天、4天和6天每次光照20分钟为最优治疗方案。
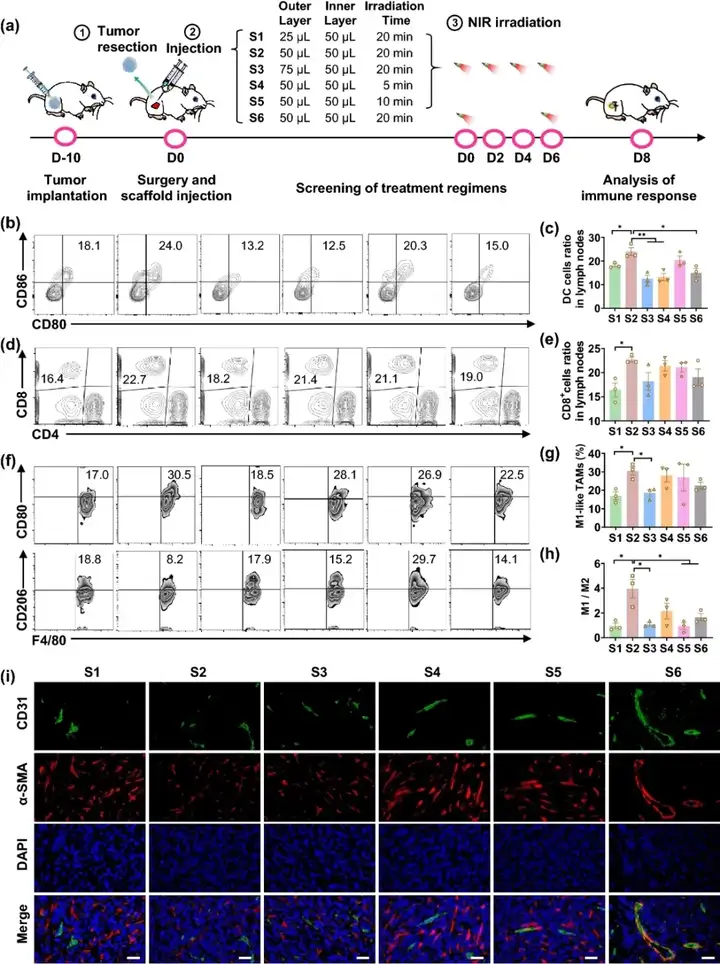
图2. (a) 不同治疗策略筛选示意图;(b, c) 引流淋巴结中DC细胞浸润情况(n=3);(d, e) 引流淋巴结中CD4⁺和CD8⁺ T细胞浸润情况(n=3);(f-h) 肿瘤中巨噬细胞浸润情况(n=3);(i) 各组第8天肿瘤微血管免疫荧光染色。(比例尺:100 μm)。
III体内抗肿瘤疗效
通过构建不完全切除的4T1-luc荷瘤小鼠模型,即待肿瘤生长至约300 mm3时,切除约90%的肿瘤,留下大约10%的肿瘤,模拟术后未完全切除的肿瘤模型。
对小鼠按照以下6组方案进行治疗:PBS不加光组(PBS组,G1)、双层未载药凝胶不加光组(LG35/65+LG50/50组,G2)、aCD47与SG混合溶液加光组(G3)、外层凝胶未载药内层载aCD47不加光组(LG35/65+aCD47@LG50/50组,G4)、外层凝胶载SG内层未载药加光组(SG@LG35/65+LG50/50组,G5)、外层凝胶载SG内层载aCD47不加光组(SG@LG35/65+aCD47@LG50/50-L组,G6)与外层凝胶载SG内层载aCD47加光组(SG@LG35/65+aCD47@LG50/50+L组,G7)。其中,内外层凝胶的体积均为50 μL,aCD47剂量均为70 μg/只,索拉菲尼的剂量均为50 μg/只。加光组小鼠分别于0、2、4 、6d施加808 nm激光光照,每次20 min。使用热成像仪持续实时监测小鼠肿瘤部位温度,手动调节激光器功率,使照射部位温度维持在42~45℃,并利用4T1-luc肿瘤细胞的发光信号检测肿瘤的生长情况。如图3所示,在23天的治疗期间,G7组,即SG@LG35/65+aCD47@LG50/50+L组肿瘤荧光明显弱于其他各组。第23天时小鼠的肿瘤体积和质量也明显低于其他各组,血管的CD31和α-SMA信号较其他各组弱此外,G7组小鼠的生存期也得到明显延长。这表明SG@LG35/65+aCD47@LG50/50+L的策略能够有效抑制肿瘤复发及肿瘤血管新生。

图3. (a) 药效及免疫应答实验设计示意图;(b) 4T1-luc荷瘤小鼠术后经各组治疗后的肿瘤荧光成像;(c) 4T1-luc荷瘤小鼠术后经各组治疗后肿瘤生长曲线(n=5);(d) 治疗后第23天每组代表性小鼠肿瘤质量;(e) 小鼠生存曲线(n=8);(f)各组第8天肿瘤微血管免疫荧光染色。(比例尺:100 μm)。
IV 免疫应答效果考察
基于上述对于肿瘤复发的良好抑制效果,本文于术后第8天对淋巴结和肿瘤部位的其他免疫细胞水平进行检测,进一步对于贯序释放索拉菲尼和aCD47的双层凝胶免疫应答效果进行考察。如图4所示,G7组的M1型巨噬细胞为19.4%,而G1组仅为8.2%;G7组的M2型巨噬细胞为8%,而G1组高达为21%,这表明索拉菲尼能够对巨噬细胞进行有效地“再教育”。对于血清中细胞因子的水平进行检测,结果显示,G7组治疗后,包括IFN-γ、TNF-α和IL-2在内的促炎细胞因子水平上调,这几种细胞因子可由M1型巨噬细胞分泌,并能够辅助T细胞介导的抑瘤免疫作用。相反,与其他组小鼠相比,G7组由M2型巨噬细胞分泌的免疫抑制性细胞因子IL-10水平显著下降。
本文进一步对其他免疫细胞水平进行考察,如图5所示,G7组小鼠淋巴结中成熟的DC细胞最多,约为20.8%,淋巴结中的CD8⁺ T细胞和CD4⁺ T细胞浸润最多。同时,与G1组相比,负载aCD47的G3和G4组的小鼠成熟的DC细胞和CD8⁺ T细胞的水平也明显升高,这表明aCD47能够有效激活T细胞介导的免疫应答。与淋巴结中结果相似,G7组的肿瘤组织中CD8⁺ T细胞和CD4⁺ T细胞浸润最多,而具有抑制细胞毒性T淋巴细胞抗肿瘤免疫效果的Treg细胞水平最低。这说明该种策略能够有效地逆转术后免疫抑制微环境,塑造肿瘤部位的免疫原性微环境。
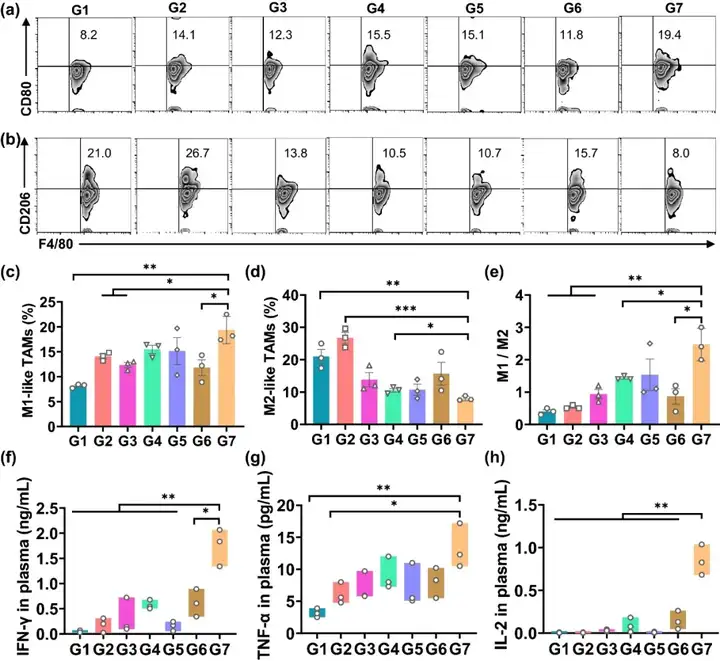
图4. (a, b) M1型、M2型巨噬细胞的流式分析图;(c) M1型巨噬细胞的比例统计;(d) M2型巨噬细胞的水平统计;(e) M1型、M2型巨噬细胞的比值;(f) 各组小鼠血清中IFN-γ的水平统计;(g) 各组小鼠血清中TNF-α的水平统计;(h) 各组小鼠血清中IL-2的水平统计。
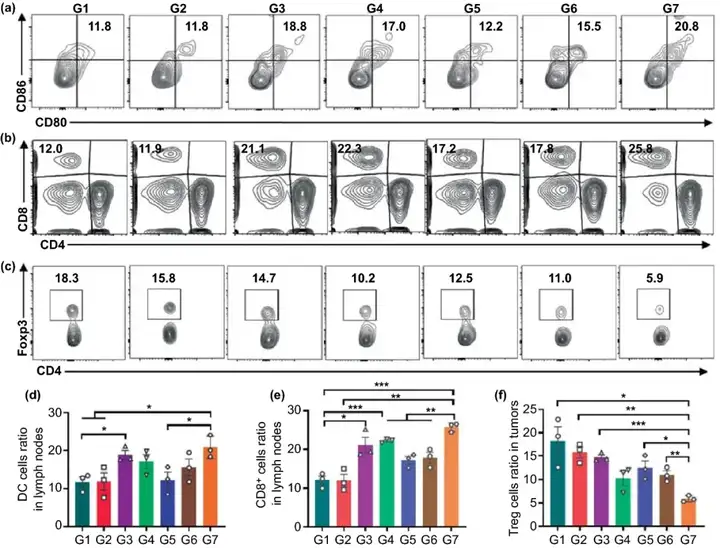
图5. (a) DC细胞的流式分析图;(b) 引流淋巴结中CD4⁺和CD8⁺ T细胞的流式分析图;(c) Treg细胞的流式分析图;(d) DC细胞的水平统计;(e) CD8⁺ T细胞的水平统计;(f) Treg细胞的水平统计。
V 长期免疫记忆效果考察
最后,本研究使用更具侵略性的全身扩散肿瘤模型对贯序释放索拉菲尼和aCD47的双层凝胶能否诱导全身免疫记忆进行探究。如图6所示,G7组的肺转移情况明显低于其他各组。对各组肺结节数目的统计结果同样显示,G7组的肺结节数目明显低于其他组,甚至比PBS组低16倍。这说明本研究的程序性释放索拉菲尼和aCD47,使用光热联合免疫阻断疗法的策略能够有效激发机体的全身免疫应答,有效地组织肿瘤的自发性转移。本研究进一步对该种策略产生的免疫记忆效果进行进一步验证。效应记忆T细胞(Effector memory T cells, TEM)可被立即激活发挥效应,而中央记忆T细胞(Central memory T cells, TCM)则需要较长的时间产生细胞毒性T细胞。在注射4T1-luc细胞的次日,G7组小鼠的淋巴结中TEM的比例最高,并且G7组的TCM与除了G3组之外的其余各组对比数量也有所增加。这些结果进一步表明,基于程序性释放索拉菲尼和aCD47、光热疗法联合免疫阻断疗法的策略有利于建立长期的抗肿瘤免疫记忆。
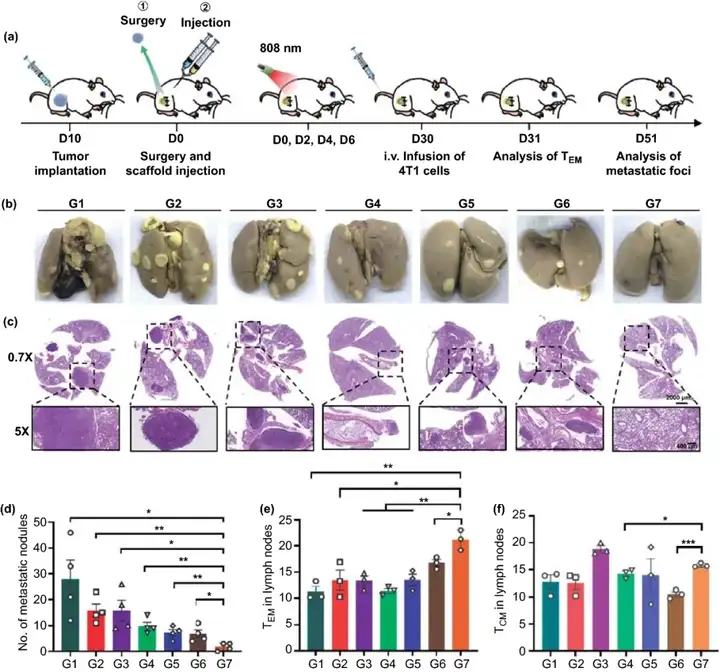
图6. (a) 免疫记忆效果及抑制肺转移实验设计示意图;(b, c) 各组小鼠术后51天肺转移情况;(d) 各组小鼠术后51天肺结节数目统计(n=4);(e) 静脉注射4T1-luc细胞次日小鼠淋巴结中TEM细胞水平;(f) 静脉注射4T1-luc细胞次日小鼠淋巴结中TCM细胞水平。
作者简介

罗亮
本文通讯作者
华中科技大学 教授▍主要研究领域
新功能材料的合成及在医学影像、生物检测、药物递送等方面的应用研究。
▍主要研究成果
自2018年来以通讯作者在Journal of the American Chemical Society、Nature Communications、Advanced Materials、Advanced Functional Materials等期刊已发表近30篇高水平论文,获批中国发明专利10余项。曾任美国康涅狄格州美中医药开发协会会长,回国后作为课题负责人承担国家重点研发计划“纳米专项”、国家自然科学基金面上项目等,先后入选国务院侨务办公室重点华人华侨创业团队、武汉市光谷3551创新人才计划等,并担任中国抗癌协会纳米肿瘤学青年专业委员会副主任委员、中国化学会分子聚集发光专业委员会委员、中国生物物理学会材料生物学与智能诊疗技术分会副秘书长。
▍Email: liangluo@hust.edu.cn
▍课题组主页
liangluogroup.wqdian.cn/

孙春萌
本文通讯作者
中国药科大学 副教授▍主要研究领域
药物新制剂和制剂新技术、智能纳米药物递送系统、肿瘤免疫治疗、靶向性细胞穿膜肽的设计、仿制药质量一致性评价、药用辅料相关研究等。
▍主要研究成果
已发表论文40余篇,其中以第一作者和通讯作者在Nature Communications, Advance Functional Materials, Journal of Controlled Release等国际权威期刊发表SCI论文20余篇。以第一发明人申请专利2项。作为主要完成人,获2016年江苏省教育科学研究成果奖科技进步奖三等奖。2017年,接受《江苏科技报》“人物”栏目专访。2017-2018年,参与国家药品审评中心《药物注射剂研发技术指导意见》、《已上市化学仿制药(注射剂)一致性评价技术要求》等文件起草工作。为2020年版《中国药典》制修订指导原则和通用检查法5项。另参编国家药典委员会专著《各国药用辅料标准对比手册》、国家高等医药院校药学类双语教材《药剂学实验与指导》等。
▍Email: suncmpharm@cpu.edu.cn

黄丽萍
本文第一作者
华中科技大学▍主要研究领域
多功能纳米生物材料用于诊疗一体化、多功能肿瘤靶向纳米递药系统的研究。
▍主要研究成果
发表SCI论文10余篇,获专利10余项。
▍Email: lphuang@aliyun.com

张一漪
本文第一作者
华中科技大学▍主要研究领域
肿瘤光疗免疫联合疗法、肿瘤药物递送。
▍Email: yiyizhang@hust.edu.cn

李亚楠
本文第一作者
南京师范大学▍主要研究领域
药物递送与肿瘤免疫。
▍主要研究成果
发表SCI论文10余篇,获专利3项。
▍Email: liyanan@njnu.edu.cn
撰稿:原文作者
编辑:《纳微快报(英文)》编辑部
本信息源自互联网仅供学术交流 ,如有侵权请联系我们立即删除。
| 温馨提示:网站部分素材源自网络,仅供学术交流勿做其他用途,如有侵权请联系我们立即删除。苏州北科纳米供应产品仅用于科研,不能用于人体,不同批次产品规格性能有差异。 |
下一篇: 纳米医学产品1


 苏公网安备32059002005573 苏ICP备2020067807号-1
苏公网安备32059002005573 苏ICP备2020067807号-1 