李仕颖/成红/余细勇ACS Nano:自递送光免疫刺激剂实现光动力增敏的肿瘤免疫治疗

将光敏剂和免疫调节剂自递送至肿瘤部位,可改善光动力免疫疗法,但这一策略仍具有挑战性。在此,广州医科大学李仕颖教授、余细勇教授和南方医科大学成红副教授联合报道了一种用于光动力增敏肿瘤免疫治疗的自递送光免疫刺激剂。
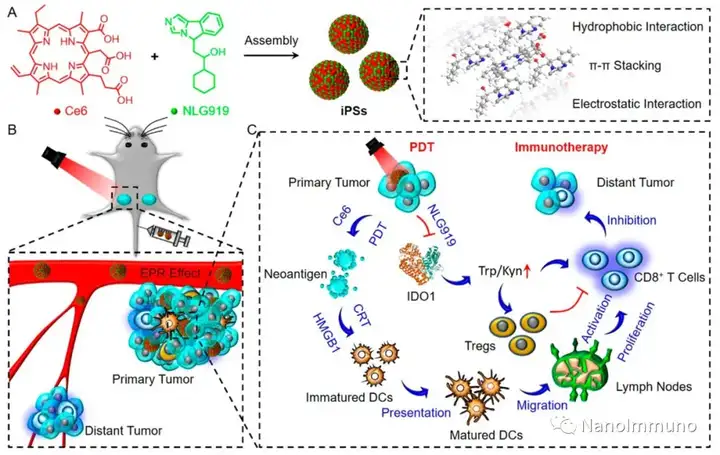
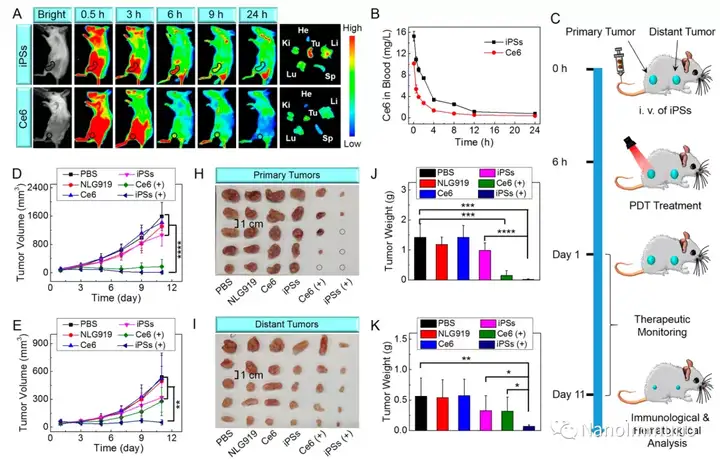
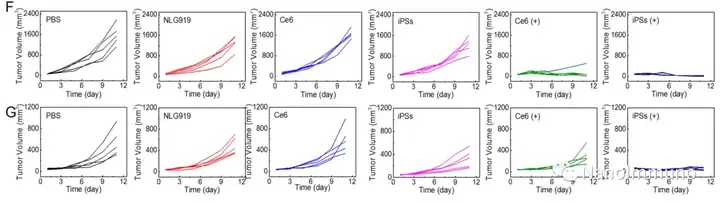
无载体的iPS是通过光敏剂Ce6和NLG919之间的非共价相互作用而自组装制备的,避免了辅料引起的毒性和免疫原性。静脉注射后,iPS倾向于被动蓄积在肿瘤部位,以触发强大的光动力治疗,并诱导免疫原性细胞死亡,激活了细胞毒性T淋巴细胞并启动了抗肿瘤免疫反应。同时,NLG919的共递送抑制了吲哚胺2,3-双加氧酶1的激活,逆转了免疫抑制的肿瘤微环境。基于iPS的光动力增敏免疫疗法可有效抑制原发性和远端肿瘤生长,且系统毒性低,为开发用于肿瘤精准治疗的可临床转化自递送纳米药物带来了启发。
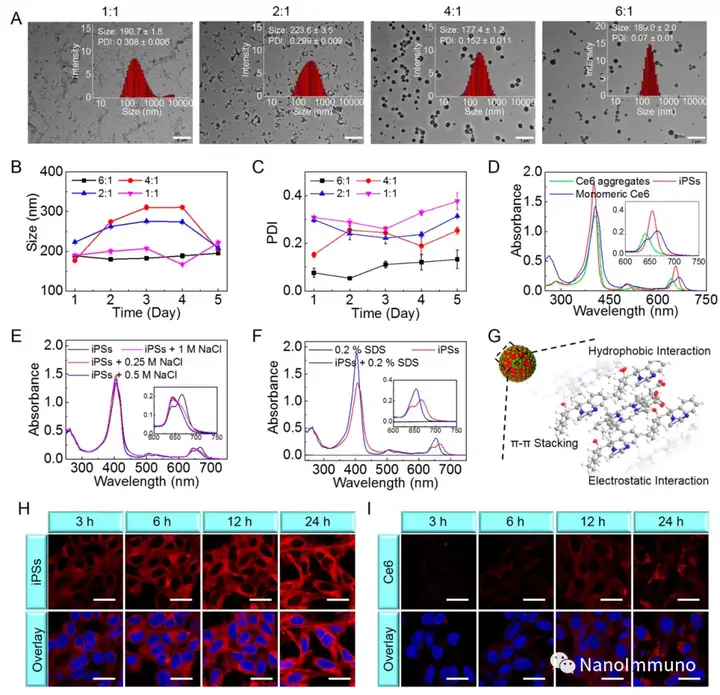
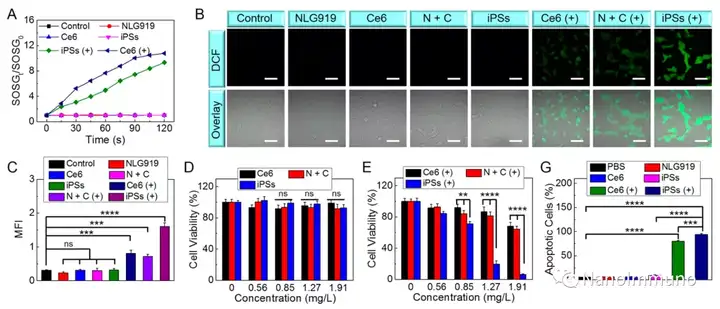
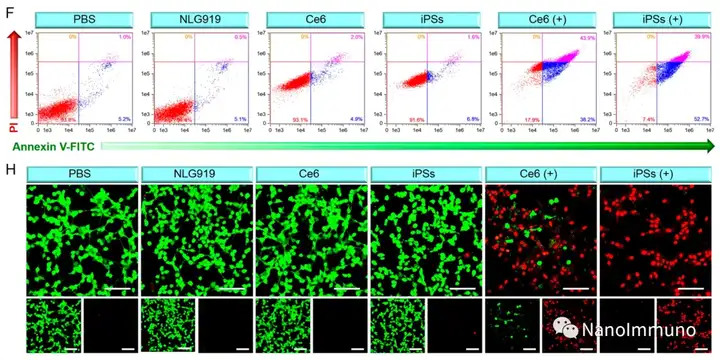
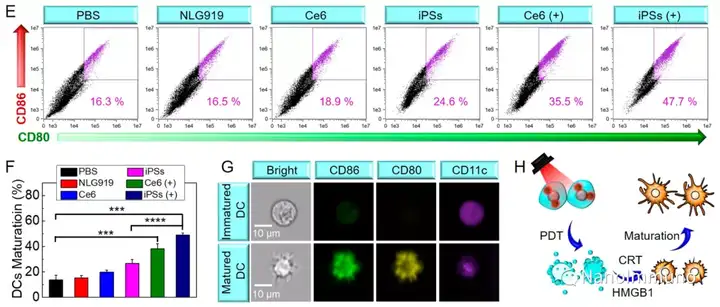
本文通过光敏剂Ce6和NLG919的自组装制备了用于光动力增敏肿瘤免疫治疗的自递送光免疫刺激剂。由于疏水,π-π堆积和静电相互作用,自组装的iPS具有改善的溶解度、稳定性和生物相容性。此外,无载体的iPS具有很高的载药率,可避免潜在的免疫原性。有趣的是,iPS的强大PDT治疗不仅可以触发肿瘤细胞凋亡,还可以通过促进钙网蛋白向细胞表面迁移和高迁移率族蛋白B1的细胞外释放引发ICD反应。成熟的DC将募集并激活CTL,实现了原发和远端肿瘤的协同免疫治疗。NLG919的共同递送抑制了IDO-1的激活和Treg的肿瘤浸润,从而逆转了免疫抑制肿瘤微环境。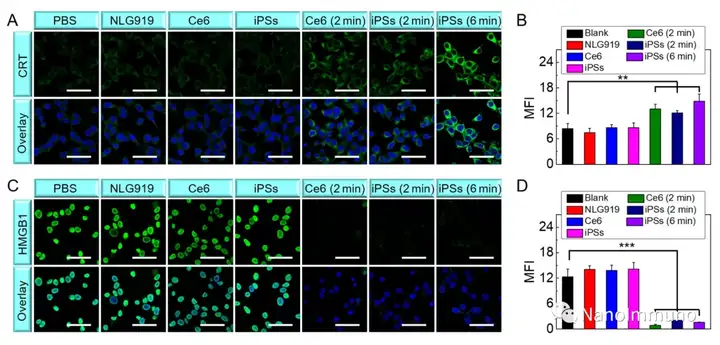
本信息源自互联网仅供学术交流 如有侵权请联系我们立即删除
| 温馨提示:网站部分素材源自网络,仅供学术交流勿做其他用途,如有侵权请联系我们立即删除。苏州北科纳米供应产品仅用于科研,不能用于人体,不同批次产品规格性能有差异。 |
下一篇: 纳米医学产品1


 苏公网安备32059002005573 苏ICP备2020067807号-1
苏公网安备32059002005573 苏ICP备2020067807号-1 