仿生构建具有类伪足表面的MOF@COF纳米酶用于抑制细菌
导语
大量研究报道金属有机框架(MOF)结构具有模拟酶的功能,但由于其类酶催化活性较低,因而使得其在催化性能和治疗效果方面不能令人满意。基于此,中科院长春应化所曲晓刚研究员和任劲松研究员等人2021年在Angewandte Chemie International Edition 上发表了“Nature-Inspired Construction of MOF@COF Nanozyme with Active Sites in Tailored Microenvironment and Pseudopodia-like Surface for Enhanced Bacterial Inhibition”一文,该研究利用源于自然的灵感设计并构建了具有定制微环境活性位点和伪足类表面的MOF@COF纳米酶(NMCTP-TTA),从而增强纳米酶的催化和治疗效率。研究中采用“顺序生长”的方法来合成NMCTP-TTA。首先溶剂热法制备NM-88并通过席夫碱反应形成NM-88-CHO,接着COF共价连接Tp 和 TTA 构建NM-88-CHO,最后将连接到NM-88-CHO上形成NMCTP-TTA。所得到的纳米粒子在活性位点周围形成特定的微孔环境,通过非共价相互作用富集和激活底物分子,这种树杈状结构纳米酶可以如同中性粒细胞“伪足”样捕获细菌并产生ROS有效地杀死细菌。
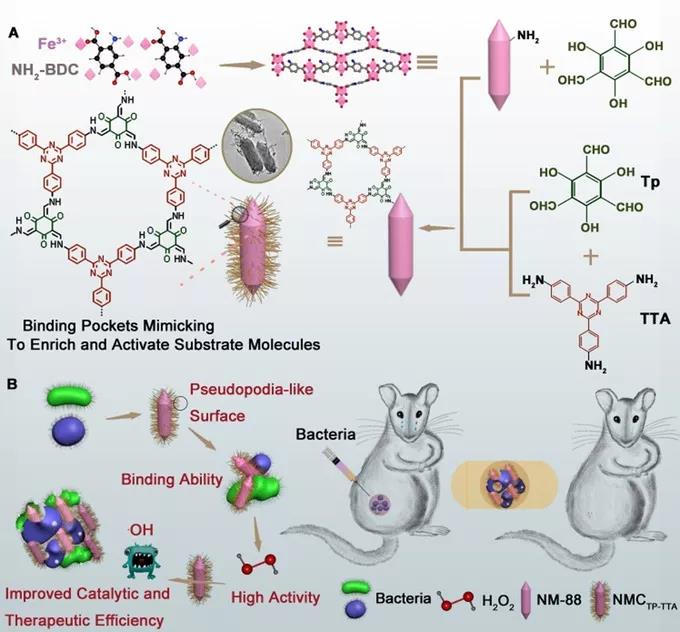
研究内容
1. MOF@COF的合成与表征
研究人员用具有过氧化物酶样活性NH2-MIL-88B(Fe)(NM-88)作为模型纳米酶,通过席夫碱反应形成醛功能化的纳米酶NM-88-CHO。用TP和TTA共价连接COF构建表面COFTP-TT。最后通过溶剂热法将COFTP-TTA和NM-88-CHO以共价连接方式形成MOF@COF纳米酶。SEM,EDS,FTIR表明MOF@COF纳米酶的成功制备(图1 A,B,C,I);COF Tp-TTA、NM-88 和 NMC Tp-TTA ζ 电位 (图1D);不同PH条件下NMC Tp-TTA和 NM-88的类过氧化物酶活性(图1F,G)。研究人员观察到与NM-88相比,MOF@COF的过氧化物酶样活性明显提高,并且仅COFTp-TTA无法催化TMB的氧化。因此,MOF@COF的增强催化能力可能归因于其在COFTp-TTA的组成和结构方面的优势以及在周围微环境提供活性位点模仿氨基酸残基的功能,激活与底物的催化反应,从而增强催化能力。扫描电镜和透射电镜观察到MOF@COF具有“伪足”形态和多孔结构。
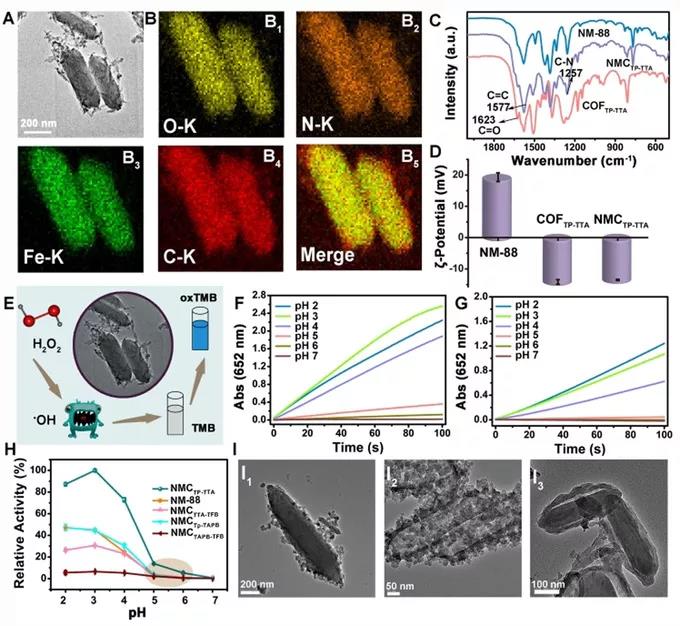
图1,A)NMCTp-TTA的TEM图像;B)EDS图像;C,D)COFTp-TTA,NM-88和NMCTp-TTA的FT-IR和ζ电位;E)NMCTp-TTA的过氧化物酶样活性示意图;F,G)通过监测pH 2–7在652 nm处TMB的吸收,NMCTp-TTA和NM-88的过氧化物酶样活性。H)对它们的过氧化物酶样活性的定性分析;I)NMCTTA-TFB,NMCTp-TAPB,NMCTAPB-TFB的TEM图像。
2. MOF@COF与细菌相互作用
基于中性粒细胞形成伪足包围并捕获细菌的行为,研究人员推测具有伪足样形态的MOF@COF可以紧密捕获细菌,并通过原位产生的ROS有效杀死细菌。接下来对MOF@COF的体外抗菌进行研究中,作者设置了六个不同的组来研究其对耐药金黄色葡萄球菌和大肠杆菌的抗菌活性,结果显示在NM-88和MOF@COF的协助下,H2O2以剂量依赖性方式显著抑制了两种细菌的生长(图2 A, B)。通过平板计数和定量分析表明,单独的NM-88几乎不会抑制细菌生长,单独的NMCTp-TTA表现出轻微的降低,而MOF@COF联合H2O2降低细菌存活率比其他组更有效(图2 E)。并且SEM测试结果表明带有伪足样的MOF@COF紧紧撕扯细菌的细胞壁,导致轻微的结构变形,这可能源于MOF@COF与细菌的细菌细胞壁之间的多价拓扑相互作用(图2 F)。MOF@COF联合H2O2的抗菌效果增强是由于MOF@COF与细菌细胞壁的结合增强,以及MOF@COF自身产生原位.OH,可更直接有效地破坏病原体。
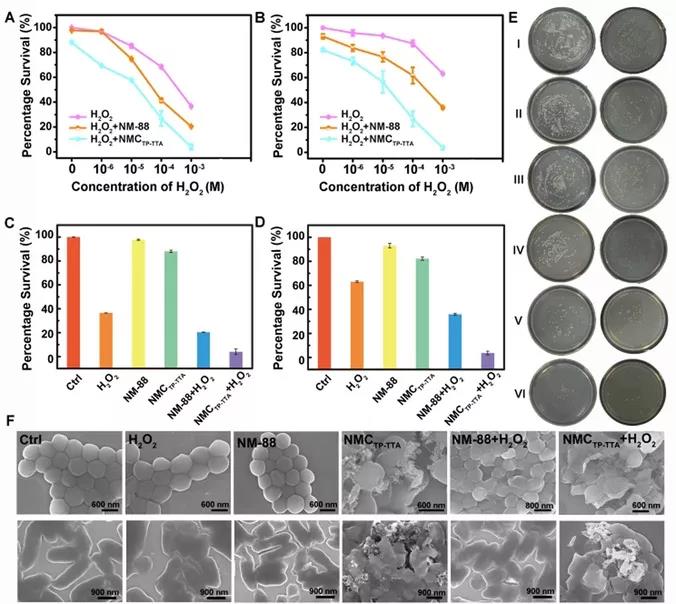
图2,在不同处理条件下与H2O2共孵育后金黄色葡萄球菌(A)和大肠杆菌(B)的存活率;不同处理后金黄色葡萄球菌(C)和(D)大肠杆菌的存活率;E)不同处理对金黄色葡萄球菌(左)和大肠杆菌(右)的菌落照片,(I)PBS,(II)H2O2,(III)NM-88,(IV)NMCTp-TTA,(V)NM-88 + H2O2,(VI)NMCTp-TTA+ H2O2;(F)金黄色葡萄球菌和大肠杆菌的SEM图像。
3. MOF@COF促进伤口愈合
接下来进一步研究MOF@COF的体内应用。通过采用小鼠伤口感染模型,探索了它们在体内消除细菌的潜力。研究人员构建金黄色葡萄球菌感染伤口模型,采用不同治疗方式。实验结果表明,NMCTp-TTA+ H2O2组中出现轻度炎症和一些胶原蛋白形成,平板计数定量分析发现NMCTp-TTA+ H2O2组的菌落最少(图3 C,D)。治疗5天后,NMCTp-TTA+ H2O2组表现出最佳的伤口愈合效果,且伤口面积最小(图3 B)。因此可以得出结论,COFTp-TTA可以增强NM-88纳米酶的催化和治疗性能,并表现出令人欣慰的抗菌效果。
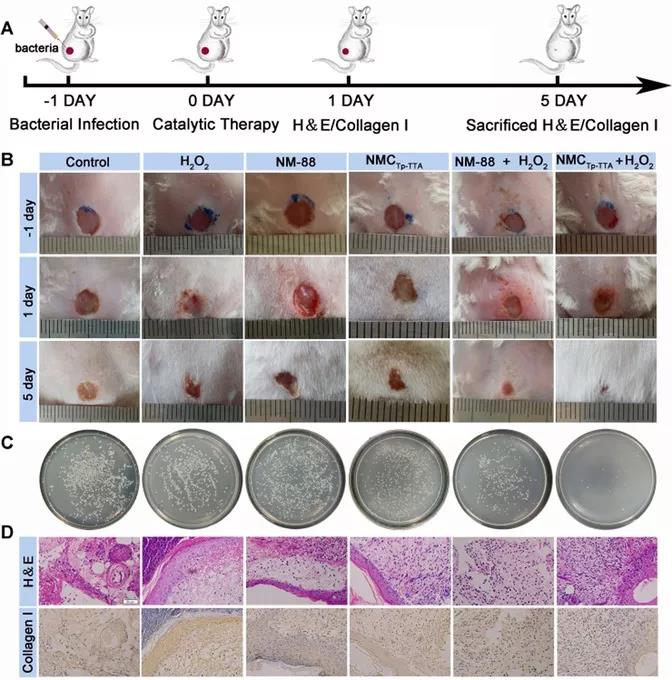
图3 ,A)对金黄色葡萄球菌伤口感染模型的治疗策略示意图;B)在第1天和第5天用不同处理方法处理的伤口感染模型的图像;(C)用不同处理方法从伤口组织中分离出的细菌菌落的图像;D)处理5天后,从小鼠获得的皮肤组织的H&E和胶原蛋白I免疫组织化学染色(比例尺为50μm)。
总结
MOF@COF纳米酶以MOF的金属节点为活性中心,随后生长的COF结构会产生多级纳米空腔以在活性位点附近形成合适的孔环境,可以富集并激活底物分子,进而增强对细菌的抑制作用。此外,COFs具有的类伪足表面使得该系统能够有效地捕捉细菌,从而进一步增强该纳米酶的治疗效率。综上所述,这一研究不仅可以促进新型纳米酶的发展,而且也将拓宽MOF/COF基杂化材料的生物学应用。
本信息源自互联网仅供学术交流 如有侵权请联系我们立即删除
| 温馨提示:网站部分素材源自网络,仅供学术交流勿做其他用途,如有侵权请联系我们立即删除。苏州北科纳米供应产品仅用于科研,不能用于人体,不同批次产品规格性能有差异。 |


 苏公网安备32059002005573 苏ICP备2020067807号-1
苏公网安备32059002005573 苏ICP备2020067807号-1 